Mappa della Poliomielite nel mondo
Epidemie di poliovirus nel mondo e paesi ( Afghanistan e Pakistan) con endemia di Wild Poliovirus
(da Polioeradication.org 2025)
Mappa della Poliomielite nel mondo Leggi tutto »
Mappa della Poliomielite nel mondo Leggi tutto »
OMS 2025
Cartografia MERS-COV Leggi tutto »

Mappa della Meningite da Meningococco Leggi tutto »

Zone rosso scuro: regioni dell’Africa subsahariana con le prevalenze più elevate (spesso superiori al 5 %).
Zone arancioni/gialle: alcune aree dell’Africa non subsahariana, parti dell’Asia meridionale e dell’America Latina mostrano prevalenze moderate.
Zone chiare: gran parte dell’Europa, Nord America, Asia orientale e Australia, con prevalenze basse (sotto lo 0,5-1 %).
Mappa dell’HIV nel mondo Leggi tutto »
Fonte: CDC Yellow Book 2025
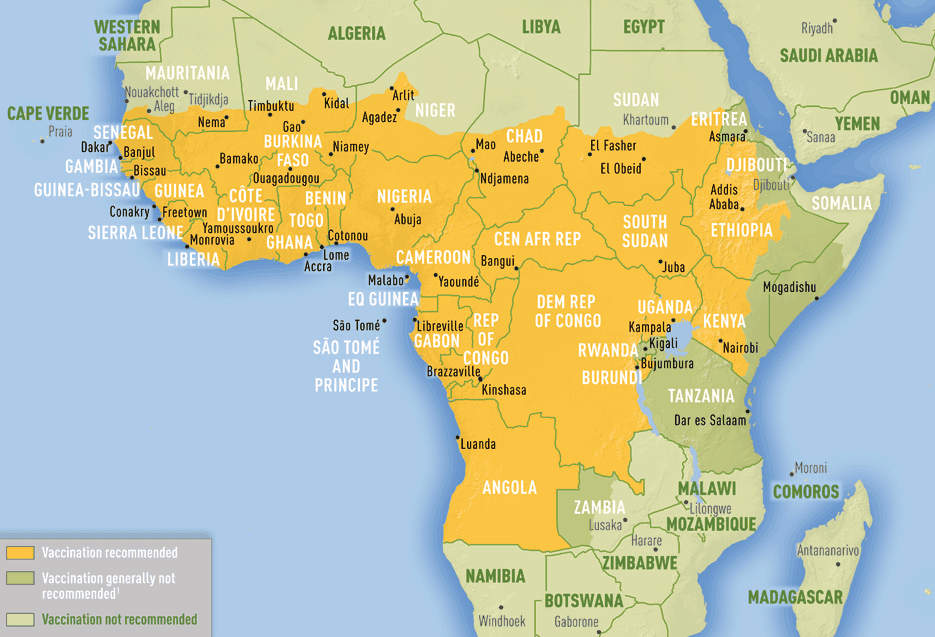
Fonte: CDC Yellow Book 2025
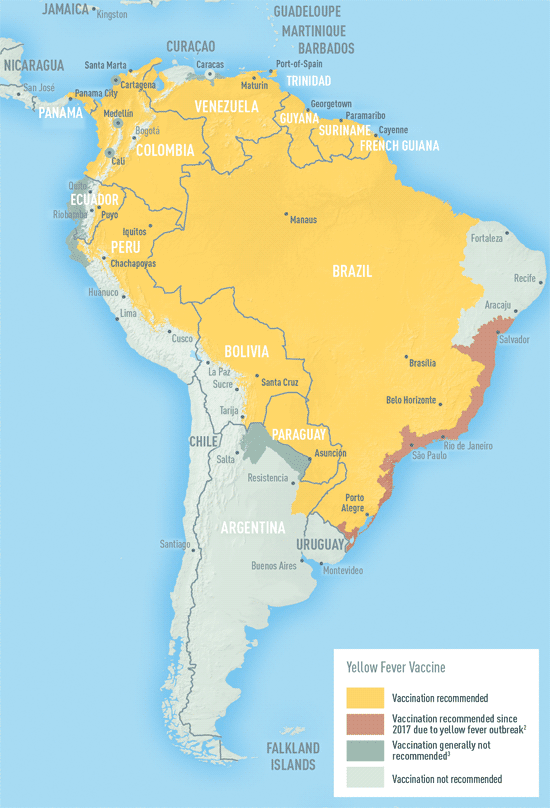
Mappa della Febbre Gialla nel mondo Leggi tutto »
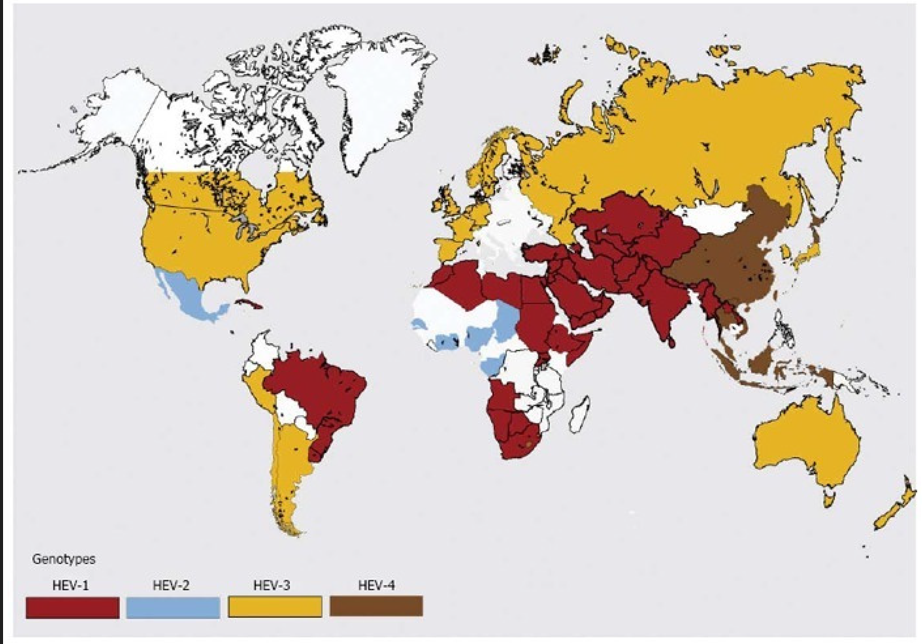
Cartografia – Epatite E Leggi tutto »
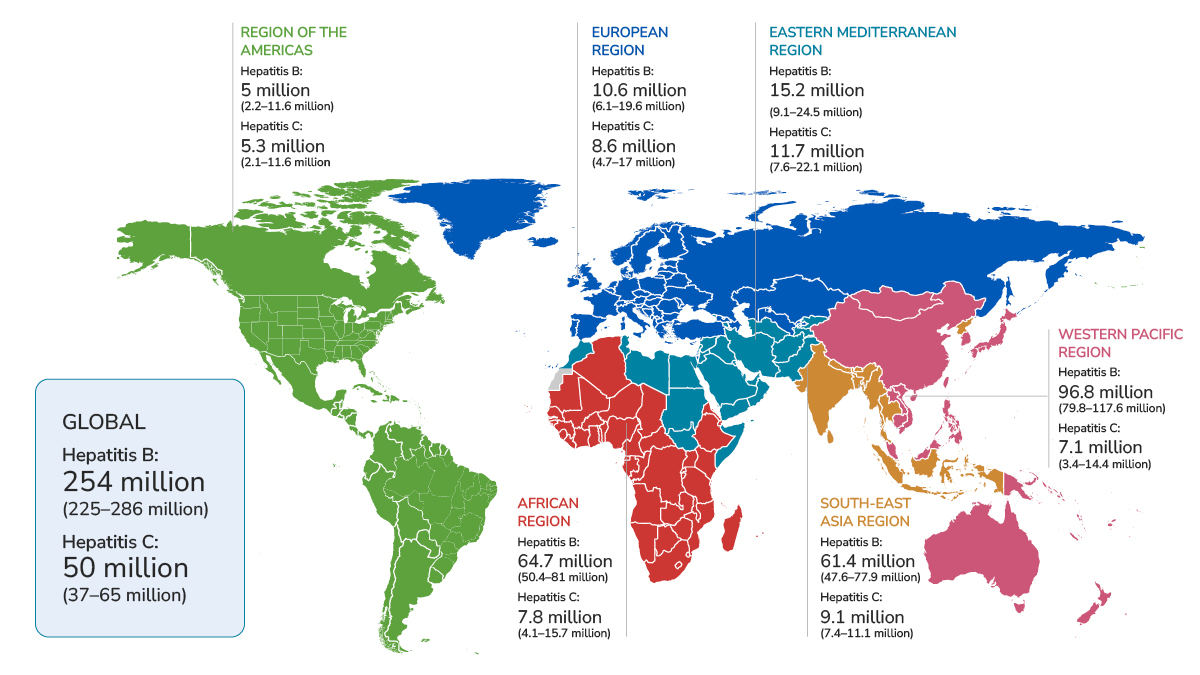
da CDC YELLOW BOOK 2025, su dati OMS del Global Hepatitis Report 2024
Cartografia – Epatite C Leggi tutto »
La mappa mostra la distribuzione globale delle infezioni croniche da epatite B (HBV) e da epatite C (HCV) per regione.

(da CDC YELLOW BOOK 2025 su dati del Global Hepatitis Report 2024 dell’OMS)
Mappa dell’Epatite B nel mondo Leggi tutto »
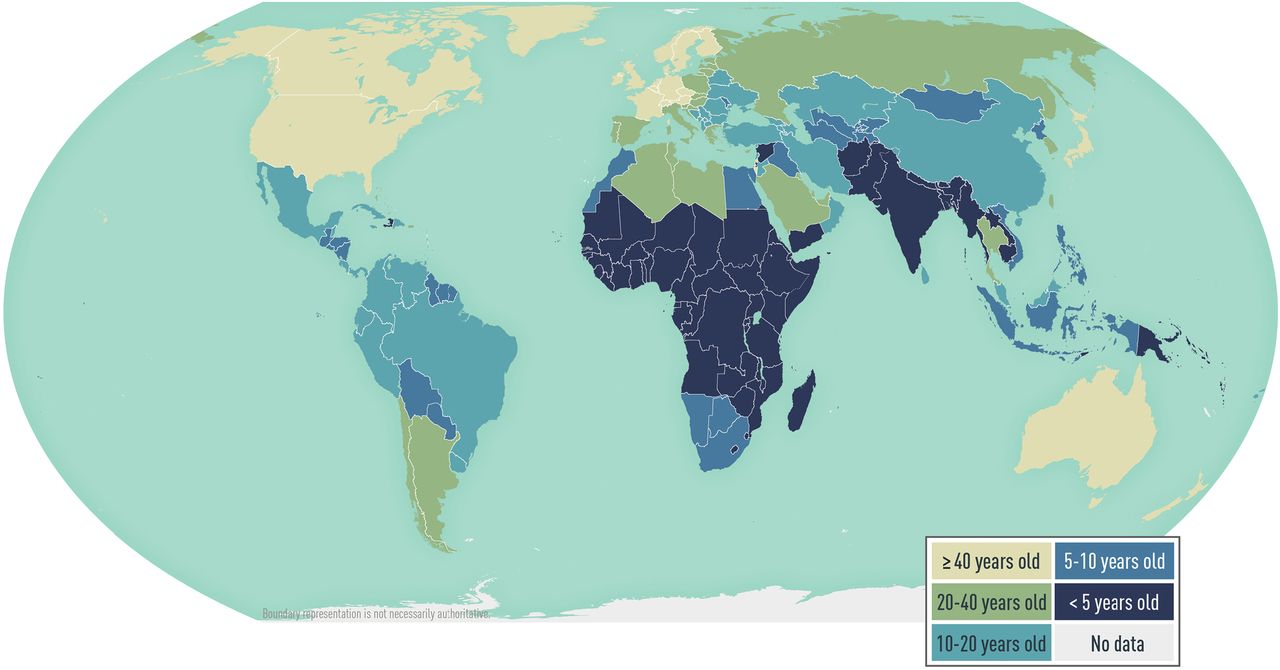
Mappa dell’Epatite A nel mondo. Leggi tutto »

Aggiornato a Marzo 2018
Cartografia – Febbre emorragica Congo – Crimea Leggi tutto »
Le aree evidenziate corrispondono ai Paesi che hanno segnalato casi di colera nei primi mesi del 2025. (ECDC, WHO, The Open Public Health Journal)
Dal 1° gennaio al 2 maggio 2025, sono stati segnalati 111 359 casi di colera e 1 562 decessi a livello mondiale. Nel 2024, nello stesso periodo, erano stati registrati 151 497 casi e 1 752 decessi.
Africa: in cima alla classifica per numero di casi e decessi – in particolare Angola, Sudan, Mozambico, Etiopia, Zimbabwe
Asia e Medio Oriente: notifiche significative da Afghanistan, Bangladesh, India, Myanmar, Nepal, Pakistan, Yemen
America: casi in Haiti – uno dei pochi in questa regione
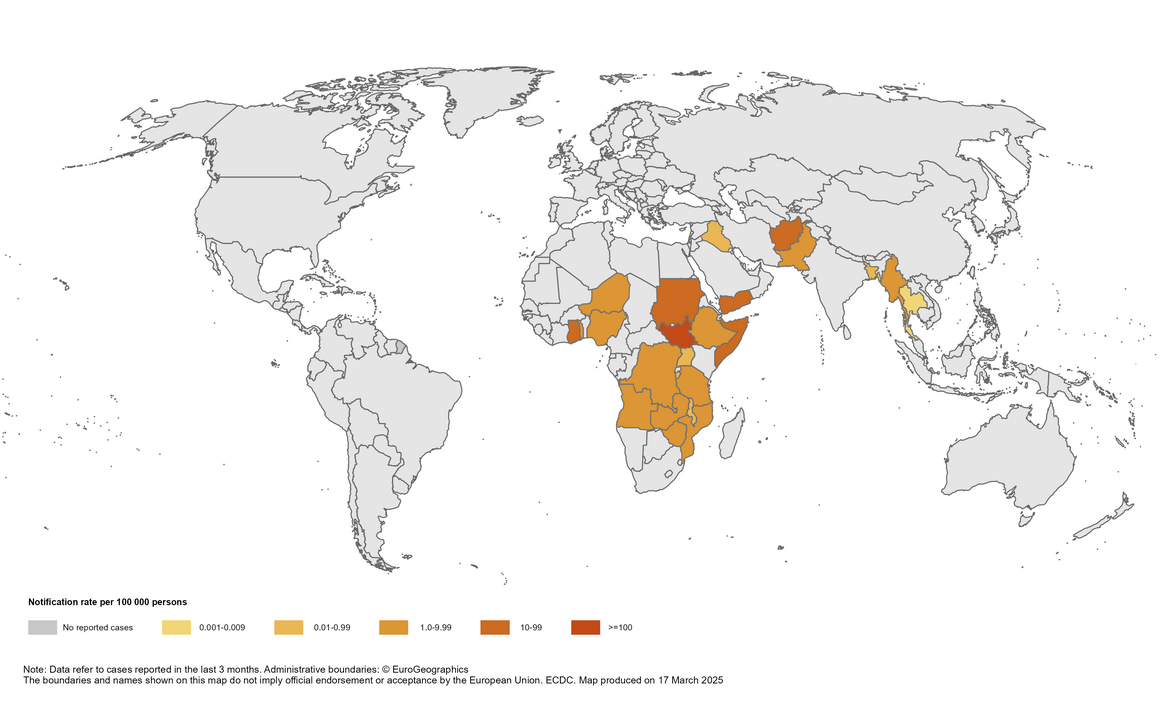
Mappa del Colera nel mondo Leggi tutto »
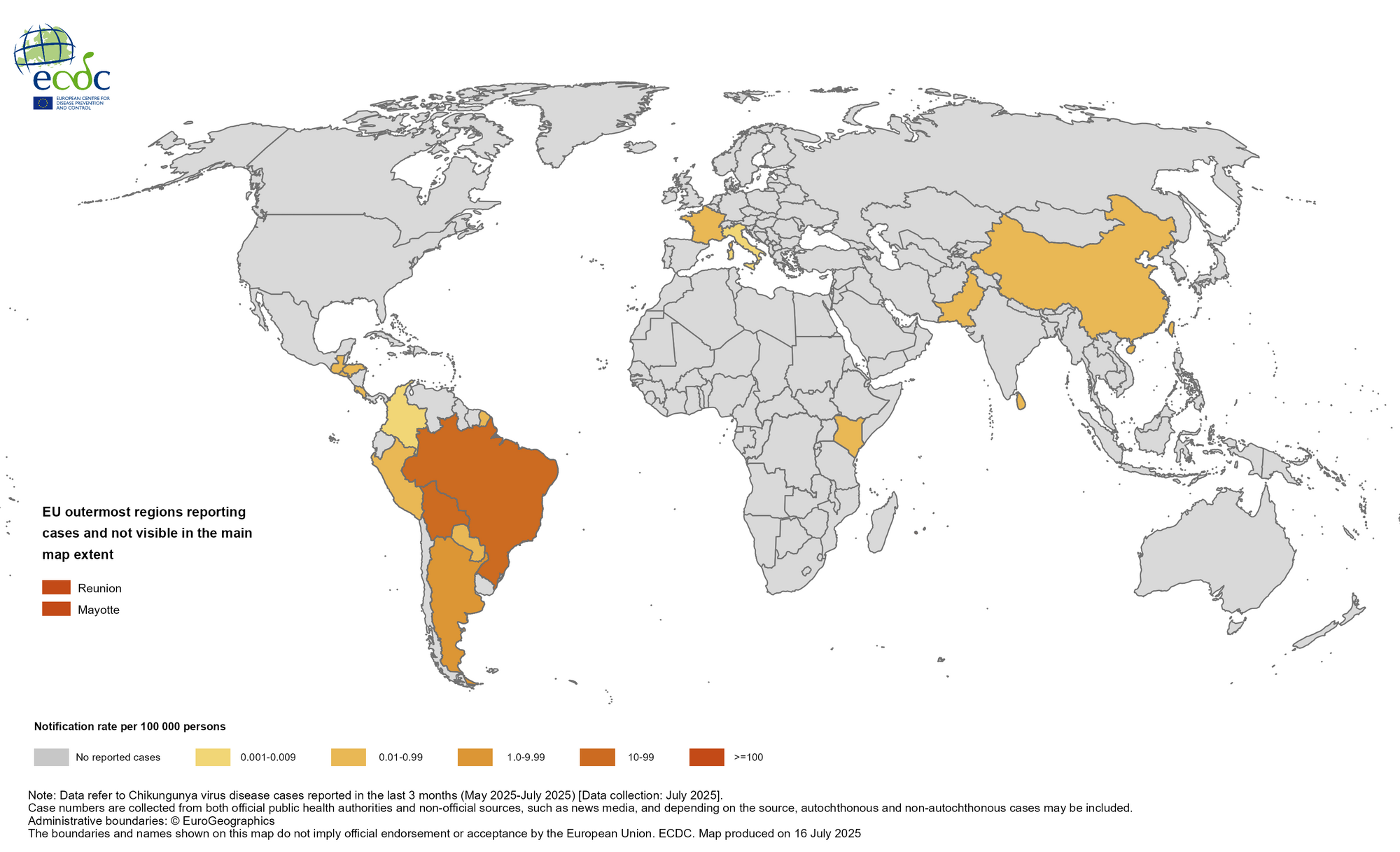
Mappa di Chikungunya nel mondo Leggi tutto »