SCHEDA MALATTIA: CHIKUNGUNYA
Descrizione Generale
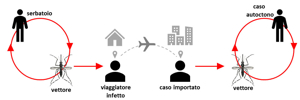
La Chikungunya è una malattia infettiva virale acuta febbrile trasmessa da artropodi, caratterizzata da febbre elevata, cefalea persistente, astenia progressiva, e soprattutto da artralgie e mialgie invalidanti che costringono il paziente ad assumere posizioni antalgiche per alleviare la sofferenza. Il nome, derivato dal vocabolo in lingua swahili “ciò che curva”, rispecchia fedelmente il quadro clinico predominante della malattia. Originariamente limitata alle aree tropicali ed equatoriali dell’Africa, dell’Asia e dell’Oceano Indiano, negli ultimi due decenni ha subito una progressiva espansione geografica, raggiungendo le Americhe, i Caraibi, e sempre più frequentemente le regioni temperate in particolare il bacino del Mediterraneo europeo. La malattia si trasmette esclusivamente attraverso la puntura di zanzare infette, in particolare del genere Aedes, e non per contatto diretto tra persone. Il serbatoio del virus è rappresentato dall’uomo, sia sintomatico che asintomatico o paucisintomatico, e in aree silvestri da piccoli mammiferi e primati.
Agente Infettivo – alphavirus
Il virus della Chikungunya (CHIKV) appartiene alla famiglia delle Togaviridae, genere Alphavirus. Si tratta di un virus a RNA a polarità positiva di circa 11,8 kb di lunghezza, contenente una struttura 5′ N7-methylguanylated cap e 3′ polyadenylated tail. Il genoma virale codifica due regioni:
(a) la prima, che occupa i due terzi del genoma, codifica quattro proteine non strutturali (nsP1, nsP2, nsP3, nsP4) essenziali per la replicazione virale e la formazione del complesso di replicazione;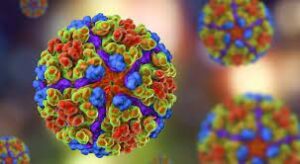
(b) la seconda, a valle del promotore subgenomico, codifica le proteine strutturali (C-E3-E2-6K-E1) necessarie per l’assemblaggio del virione e per l’interazione con le cellule ospite.
Il virus è morfologicamente sferico con diametro di 60-70 nanometri, rivestito di un doppio strato lipidico dal quale emergono 240 trimeri di proteine di superficie E1-E2. La replicazione virale avviene in ultrastructture derive da membrane cellulari denominate “sfere di replicazione” (spherules) che contengono il template di RNA a polarità negativa e il complesso di replicazione, permettendo una rapida ed efficiente sintesi di RNA genomico e subgenomico minimizzando l’esposizione agli interferoni cellulari.science
Virus strettamente correlati includono l’O’nyong-nyong virus e il Sindbis virus. Tuttavia, le variazioni genetiche e le mutazioni di alcuni ceppi, in particolare durante le epidemie di grande portata, hanno portato a differenze significative nelle modalità di trasmissione e nella competenza vettoriale di determinate specie di zanzare.
Ciclo Vitale e Trasmissione
Vettori e Modalità di Trasmissione
Diverse specie di zanzare sono coinvolte nella trasmissione e nel mantenimento del virus in natura:
-
Aedes aegypti: Principale vettore urbano in Africa e nelle Americhe. Dotata di alta competenza vettoriale e responsabile delle maggiori epidemie. Trasmette il virus sia verticalmente (da zanzara madre alla progenie) che orizzontalmente.
-
Aedes albopictus (zanzara tigre): Originaria dell’Asia, attualmente distribuita in Europa, Nord America, e aree temperate. Costituisce il principale vettore in Europa e nel bacino del Mediterraneo. Sebbene abbia dimostrato capacità di infettarsi e trasmettere il virus, la trasmissione verticale non è stata definitivamente provata in questa specie, riducendo la sua competenza vettoriale complessiva rispetto ad A. aegypti.pmc.ncbi.nlm.nih
-
Aedes africanus: Specie silvestre presente in Africa responsabile della trasmissione enzomica in ambienti forestali e savane.
-
Culex spp.: Ha dimostrato capacità di infettarsi e trasmettere il virus nel bacino del Mediterraneo, sebbene con efficienza minore rispetto a Aedes.
-
Artropodi del genere Mansonia: Responsabili della trasmissione silvestre in Africa, in particolare nelle savane.
Serbatoi Animali
In ambienti urbani, l’uomo è il principale serbatoio. In aree rurali e silvestri, i serbatoi includono primati (babbuini, circopitechi), piccoli mammiferi e roditori. La trasmissione silvestre è facilitata dalla prossimità tra popolazioni umane e ambienti endemici.
Ciclo di Infezione della Zanzara
Quando una zanzara femmina si alimenta di sangue da un ospite viremico, ingerisce il virus che si moltiplica nei tessuti dell’insetto, in particolare nelle ghiandole salivari. Il periodo di replicazione virale nelle ghiandole salivari è stimato in circa 10 giorni. Durante questo periodo, la zanzara diventa infettante e può trasmettere il virus attraverso la saliva durante il pasto di sangue.
La vita media della zanzara è stimata tra 15 e 30 giorni. Le uova di Aedes albopictus possono sopravvivere disseccate per molti mesi, anche in ambienti secchi e freddi, permettendo il mantenimento del virus in territori apparentemente non idonei durante i periodi sfavorevoli.
Viremia nell’Ospite Umano
Una volta inoculato il virus dalla zanzara nell’uomo attraverso la saliva attraversa la barriera cutanea e dermica e accede al flusso sanguigno, causando una viremia che persiste da 3 a 10 giorni—periodo che inizia prima della comparsa dei sintomi e prosegue fino ai 5-7 giorni di malattia manifesta. Durante questo periodo di viremia, le zanzare che pungono il paziente possono infettarsi e re-innescare il ciclo di trasmissione.
Le difese naturali della cute e del derma, attraverso l’immunità innata e i processi infiammatori, sono in grado di neutralizzare il virus inoculato nella maggior parte degli individui. In caso di neutralizzazione efficace, possono essere rilevati movimenti immunitari mediante diagnostica sierologica (senza che la malattia si sia manifestata).
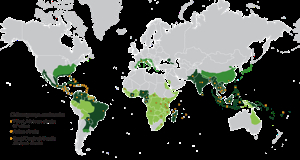
Distribuzione Geografica ed Epidemiologia
Storico di Espansione e Aree Endemiche
Il virus della Chikungunya è stato descritto per la prima volta nel 1952 in Tanzania, nelle savane al confine con il Kenya e in villaggi costieri del lago Vittoria. Descrizioni cliniche storiche di febbri “spaccaossa” risalgono al 1779 nell’Indonesia. A partire dagli anni ’50 del XX secolo, diverse epidemie sono state segnalate sistematicamente in Asia e Africa.medicoebambino
2005-2006: Epidemia dell’Oceano Indiano
Nel marzo 2005 scoppiò un’importante epidemia a La Réunion, che si diffuse in altre aree dell’Oceano Indiano. Al 17 marzo 2006, l’OMS stimò circa 204.000 persone infettate a La Réunion (pari a un terzo della popolazione di 705.000 abitanti). L’epidemia si estese a Mauritius, Madagascar, Mayotte, Seychelles, e altre isole dell’Oceano Indiano, fornendo evidenza della vulnerabilità di queste aree.
2005-2007: Primi Casi in Europa
Nel 2006 l’Europa registrò i primi casi importati: Francia (307 casi), Germania (17), Belgio (12), Regno Unito (9), Norvegia (1), Repubblica Ceca (1). In Italia, al 13 giugno 2006 erano stati confermati 11 casi in pazienti che avevano viaggiato in paesi endemici. Un caso di probabile trasmissione autoctona fu segnalato in Francia in un infermiere esposto accidentalmente al sangue durante l’assistenza.
2007: Focolaio Italiano di Ravenna
Nella seconda metà di agosto 2007, la regione Emilia-Romagna notificò un focolaio epidemico a Ravenna con 197 casi segnalati al 4 settembre, di cui 166 rispondevano completamente ai criteri di caso. Il focolaio iniziale si verificò a Castiglione di Cervia e Castiglione di Ravenna, con cluster secondari nelle periferie di Cesena (13 casi) e Cervia (6 casi). Furono riportati 101 casi confermati di laboratorio, con il virus isolato da Aedes albopictus.epicentro.iss
2017: Outbreak di Anzio
Nel agosto 2017 tre casi accertati di Chikungunya furono segnalati nel comune di Anzio, provincia di Roma, con identificazione di alcune zanzare infette e immediata bonifica dei focolai.
2013-2016: Diffusione nelle Americhe
A fine 2013 la prima epidemia di Chikungunya nelle Americhe fu segnalata in isole Caraibiche. Dalla fine del 2014, oltre un milione di casi sono stati riportati in diversi paesi Caraibici, dell’America Centrale e del Sud. Il virus continua a circolare coinvolgendo frequentemente viaggiatori da aree temperate.
Situazione Epidemiologica Globale 2025
Africa e Sahel
I casi di Chikungunya sono primariamente localizzati nella regione del Sahel africano, dove vivono circa 33 milioni di persone. Paesi come Senegal, Gambia, Burkina Faso, Kenya, Mali, e Somalia hanno registrato epidemie significative.
Nel 2023-2024, Senegal ha riportato oltre 280 casi confermati, principalmente nelle regioni di Kedougou e Tambacounda. L’Africa CDC ha segnalato oltre 1.900 casi di Chikungunya a luglio 2025, con focolai attivi in Madagascar, Maurizio, Mayotte, La Réunion (dove è diventata endemica da agosto 2024 con oltre 47.000 casi confermati),
Kenya, Somalia, e Sri Lanka con 151 casi segnalati tra novembre 2024 e marzo 2025.who+2
India e Sud-Est Asiatico
L’India rappresenta un’area di endemicità storica. Nel 2022 furono riportati 2.974 casi. Uno studio del 2025 prevedeva che 5,1 milioni di persone in India potrebbero essere a rischio di infezione ogni anno, con potenziale espansione fino a 12,1 milioni se la malattia raggiungesse regioni attualmente non colpite. L’Indonesia, paese endemico con trasmissione sporadica, continua a registrare casi. Sri Lanka dopo l’epidemia del 2006 ha registrato casi intermittenti con ricrudescenza nel 2024-2025.medicalxpress+1
Americhe e Caraibi
Nel 2024 la Pan American Health Organization (PAHO) ha riportato 431.408 casi di Chikungunya. Nel 2025, fino ad agosto, 14 paesi delle Americhe hanno segnalato 212.029 casi sospetti e 110 morti, con oltre il 97% concentrato in Sud America, in particolare in Bolivia, Brasile, Paraguay e Perù. I casi sono associati ai genotipi asiatico e ECSA (East/Central/South African), rappresentando uno shift nei pattern osservati dal 2014. Nel 2025 i casi sono aumentati ulteriormente, con 427.622 casi riportati nel 2024 secondo fonti globali.paho+1
Europa e Bacino Mediterraneo 2025
La situazione epidemiologica in Europa ha subito una drammatica trasformazione nel 2025. Al 15 settembre 2025, l’OMS ha registrato:
-
Francia: 479 casi distribuiti in 54 cluster, con 40 cluster attivi. Al 19 ottobre 2025, 734 casi erano stati segnalati.who+1
-
Italia: 205 casi localmente acquisiti distribuiti in quattro cluster, di cui tre attivi. Al 19 ottobre 2025, 364 casi confermati in diverse province dell’Emilia-Romagna e altre regioni, inclusi comuni come Carpi, San Prospero, Soliera, Novellara, Cavezzo, Modena, Nonantola, Correggio, Novi di Modena, e Cesenatico.vax-before-travel+1
-
Totale Regione Europea: 56.456 casi di Chikungunya nel 2025.who
Rappresenta il primo grande focolaio autoctono di Chikungunya in Europa da quando la zanzara tigre ha colonizzato il continente, testimoniando la vulnerabilità dell’Europa all’infezione dovuta alla presenza di vettori competenti (Aedes albopictus) e alle condizioni climatiche favorevoli durante i mesi estivi e autunnali (luglio-ottobre).pmc.ncbi.nlm.nih
Caratteristiche di Distribuzione Geografica e Fattori Climatici
La trasmissione della Chikungunya in Europa dipende da:
-
Caratteristiche climatiche: Temperatura, umidità e precipitazioni favorevoli alla riproduzione di Aedes albopictus
-
Densità di popolazione suscettibile: Elevata in ambienti urbani e periurbani
-
Densità dei flussi migratori: Introduzione del virus attraverso persone viremiche (sintomatiche o asintomatiche) provenienti da aree endemiche
-
Stato dell’interazione ospite-vettore: Immunità pregressa, concentrazione virale, infezioni precedenti da ceppi diversi
In molti paesi europei (Francia, Germania, Norvegia, Svizzera), la febbre Chikungunya era stata diagnosticata nei viaggiatori, ma la trasmissione locale non era mai stata riportata fino al 2005-2006. Il rischio è attualmente considerato limitato a piccole aree dell’Europa meridionale (bacino del Mediterraneo, Italia, Spagna Francia), con potenziale espansione verso nord grazie alla progressiva migrazione di Aedes albopictus in nuove aree geografiche.climate-adapt.eea.europa+1
LA MALATTIA
Periodo di Incubazione
Il periodo di incubazione va da 3 a 10 giorni, con media di 4-6 giorni. Una minoranza di pazienti può presentare sintomi entro 2-3 giorni, mentre altri possono sviluppare la malattia fino a 10-14 giorni dopo l’esposizione. Questo periodo è critico per la diagnosi e la comunicazione del rischio ai pazienti di ritorno da aree endemiche.
Presentazione Clinica e Sintomatologia
La Chikungunya presenta tipicamente un andamento bifasico.
(A) Fase Acuta (6-10 giorni)
La fase acuta è caratterizzata dall’esordio improvviso di:
-
Febbre: Generalmente elevata (38-40°C), spesso a picco nei primi 2-3 giorni, risolvibile dopo 3-7 giorni dall’esordio.
-
Cefalea: Persistente e rilevante, spesso frontale o occipitale.
-
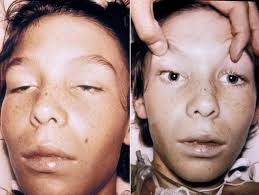
Artralgie: Diffuse e incapacitanti, colpendo prevalentemente articolazioni distali (polsi, caviglie) e articolazioni piccole delle mani e dei piedi. Le articolazioni grandi possono essere interessate, con gonfiore prominente. Il dolore articolare è spesso descritto come “lancinante” e costretto il paziente ad assumere posizioni antalgiche curve e contorte, da cui il nome della malattia.
-
Mialgie: Diffuse, particolarmente intense nella muscolatura paravertebrale, nei muscoli degli arti e nella muscolatura facciale.
-
Astenia: Grave e progressiva, costringendo il riposo a letto.
-
Manifestazioni cutanee: Esantema maculo-papulare pruriginoso, tipicamente su tronco e arti, più diffuso nella prima metà della malattia. In alcune epidemie, particolarmente in Asia, sono state riportate manifestazioni emorragiche transitori quali petecchie, ecchimosi, epistassi, e gengivorragie, tuttavia di minore severità rispetto alla dengue emorragica.
(B) Fase Subacuta (2-3 giorni)
Una seconda fase subacuta segue il calo della febbre, caratterizzata da:
-
Secondo picco febbrile meno pronunciato del primo
-
Ricorrenza o peggioramento dell’esantema: Maculo-papulare e pruriginoso su tutto il corpo
-
Persistenza di artralgie e mialgie: Spesso pari o superiore alla fase acuta
(C) Complicanze Acute
La Chikungunya è generalmente a decorso benigno e autolimitante, tuttavia possono verificarsi complicanze:
-
Manifestazioni neurologiche (rari): Particolarmente nei bambini piccoli, includono convulsioni, encefalopatia, meningoencefalite. La prevalenza di malattia del sistema nervoso centrale è riportata nel 47% dei pazienti ospedalizzati in alcuni studi. Sono stati segnalati anche rari casi di sindromi simili alla sclerosi laterale amiotrofica (ALS-like), neuropatie craniali, e sindrome di Guillain-Barré, soprattutto in pazienti con infezione duale Zika-Chikungunya. Pazienti con infezione duale presentavano malattia più aggressiva del Guillain-Barré, richiedendo supporto di terapia intensiva e ospedalizzazione più prolungata (mediana 24 giorni vs. 17 giorni).thelancet
-
Miocarditi e scompenso cardiaco acuto: Raramente riportati.
-
Manifestazioni emorragiche: Rare, con comparsa limitata di petecchie, mai importanti sanguinamenti quali si osservano nella dengue grave. Non sono mai state documentate coagulopatie significative.
-
Shock settico da coagulazione intravascolare disseminata (DIC): Complicanza gravissima ma estremamente rara.
-
Insufficienza renale acuta: Segnalata in rari casi.
(D) La mortalità
complessiva è bassa (0,4%), ma la malattia può essere fatale, particolarmente in:
-
Soggetti anziani (età >60 anni con mortalità >2%)pmc.ncbi.nlm.nih
-
Pazienti con sottostanti patologie di base (cancro, trapianti, broncopneumopatia cronica ostruttiva, cardiopatie, diabete, immunocompromissione)
-
Neonati e bambini di età inferiore a 1 anno
-
Persone di età superiore a 75 annipmc.ncbi.nlm.nih
I gruppi a più alto rischio di ospedalizzazione includono neonati e anziani.pmc.ncbi.nlm.nih
(E) Fase Cronica (Postacuta)
Una proporzione significativa di pazienti sviluppa una fase cronica caratterizzata da:
-
Persistenza di artralgie e mialgie: Che possono durare da settimane a mesi, occasionalmente fino a un anno o oltre. In alcuni studi, il 65% dei pazienti continua a riferire artralgie dopo 3 mesi, il 40% dopo 6 mesi, e il 10-15% dopo un anno.journals.plos
-
Poliartralgia e poliartrite ricorrenti o remittente: Con gonfiore articolare, tenosinovite ipertrofica a polsi e caviglie.
-
Mialgia persistente: Specialmente negli arti superiori e cosce.
-
Astenia cronica e affaticamento: Significativamente incapacitante.
-
Disturbi del sonno: Comuni e correlati al dolore cronico.
-
Lesioni cutanee residue: Pigmentazione anomala, cicatrici
-
Sintomi neuropsichiatrici: Depressione, ansia, disturbi cognitivi (brain fog).
-
Disturbi gastrointestinali: Diarrea, nausea ricorrenti.
Le manifestazioni croniche riducono significativamente la qualità della vita, con implicazioni nel lavoro e nella sfera sociale. La prevalenza di malattia cronica è estremamente comune: uno studio sistematico ha trovato l’artralgia come manifestazione predominante della fase cronica. journals.plos
Modalità di Trasmissione e Porta d’Ingresso
Il virus della Chikungunya è un arbovirus diffuso globalmente nelle aree tropicali, equatoriali e sempre più nei paesi temperati. È classificato come antropo-zoonosi, presente in diversi animali e capace di causare malattia nell’uomo.
Trasmissione Primaria: Puntura di Zanzara
La trasmissione primaria avviene esclusivamente attraverso la puntura di zanzare infette del genere Aedes, in rari casi Culex. L’inoculazione del virus nella saliva della zanzara avviene durante il pasto di sangue. Anopheles non può trasmetterlo.
La trasmissione verticale (da zanzara madre alla prole) è stata dimostrata in Aedes aegypti, africanus, e altri, costituendo uno dei motivi principali del mantenimento della trasmissione nei territori coinvolti. Tuttavia, non è stata provata in Aedes albopictus nel bacino del Mediterraneo, il che rappresenta un fattore favorevole per il controllo della malattia in Europa.
Assenza di Trasmissione Diretta Persona-Persona
Il virus non si trasmette da persona a persona attraverso:
-
Contatti quotidiani normali
-
Via aerea (goccioline respiratorie) NO
-
Rapporti sessuali
-
Contatto cutaneo
Tuttavia, non si può escludere in modo assoluto la possibilità di contagio interumano raro in condizioni eccezionali di prolungato contatto stretto con pazienti malati, attraverso esposizione a fluidi organici (sangue, saliva).
Trasmissione Verticale (Gestazionale)
La trasmissione madre-feto durante la gravidanza, particolarmente nel terzo trimestre, è possibile e documentata. Sono stati segnalati casi di infezione congenita con manifestazioni neonatali gravi incluse meningoencefalite, congiuntivite emorragica, trombocitopenia, anemia, e morte perinatale. Il rischio è maggiore se l’infezione materna avviene durante il terzo trimestre.epicentro.iss
Trasmissione Trasfusionale e Trapiantale
La trasmissione attraverso trasfusioni di sangue è possibile ma difficile, documentata in rari casi. La trasmissione attraverso trapianti è stata raramente riportata. Tuttavia, in aree endemiche, è importante implementare test sierologici o molecolari nei donatori di sangue durante epidemie.
Meccanismo di Infezione Cellulare
Una volta inoculato il virus dalla zanzara nell’uomo:
-
Il virus attraversa la barriera cutanea e dermica indenne
-
Accede al flusso sanguigno attraverso le cellule endoteliali dei capillari
-
Si moltiplica in tessuti della risposta immunitaria innata (cellule dendritiche, macrofagi) e in altri tessuti, produttori di interferon
-
La viremia persiste da 3 a 10 giorni (inizia prima della comparsa dei sintomi, continua fino a 5-7 giorni della malattia sintomatica)
Durante il periodo di viremia, le difese naturali della cute e del derma, attraverso l’immunità innata (interferone, complemento) e i processi infiammatori, possono neutralizzare il virus in molti individui, prevenendo l’infezione manifesta (infezione subclinica). In questi casi, possono essere rilevati movimenti immunitari tramite diagnostica sierologica (anticorpi neutralizzanti) senza che l’infezione clinica sia avvenuta.
Fattori Facilitanti l’Attecchimento Epidemico
Per innescare un focolaio epidemico stabile, sono necessari:
-
Presenza di molti serbatoi (individui viremiaci, sintomatici o asintomatici)
-
Alta densità di zanzare competenti che pungono ripetutamente
-
Condizioni climatiche favorevoli (temperature, umidità, precipitazioni)
-
Densità di popolazione suscettibile (mancanza di immunità pregressa)
L’evento di attecchimento è eccezionale, specialmente in Europa, dove più frequentemente si presentano casi sporadici autoctoni piuttosto che epidemie autoctone stabili, a causa della ridotta competenza vettoriale di Aedes albopictus e della bassa trasmissione verticale nella zanzara tigre.
Diagnosi
La diagnosi clinica è suggerita dal contesto epidemiologico (viaggi in aree endemiche), dal profilo sintomatologico caratteristico (febbre elevata bifasica, artralgie incapacitanti diffuse), e dall’assenza di alternative diagnostiche. La diagnosi di laboratorio è essenziale per la conferma e per la sorveglianza epidemiologica.
Metodi Sierologici (Rilevazione di Anticorpi)
Immunoglobuline M (IgM)
-
Sono normalmente rilevabili dal 5° al 7° giorno dall’esordio dei sintomi, anche se alcuni pazienti possono non presentare IgM fino al 9° giorno pmc.ncbi.nlm.nih
-
Indicano infezione recente (entro ultime 2-4 settimane)
-
Persistono per 2-3 mesi
-
Test disponibili: ELISA (MAC-ELISA – anticorpo cattura), immunofluorescenza indiretta (IFA), rapid lateral flow tests
-
Limitazione: Nei pazienti con febbre <5 giorni, le IgM possono essere ancora negative malgrado viremia attiva
Immunoglobuline G (IgG)
-
Compaiono a partire dalla seconda settimana della malattia
-
Indicano infezione pregressa o immunità
-
Persistono a lungo (anni/vita)
-
Utili per studi sieropravalenza e identificazione di infezioni precedenti
Test di Inibizione dell’Emoagglutinazione (HI) e Neutralizzazione
-
Misurano il titolo anticorpale
-
Non permettono differenziazione tra IgM e IgG se non associati a tecniche di classe specifica
-
Richiedono due campioni sierici (fase acuta e convalescente) per diagnosi definitiva
-
Meno pratico nei setting di urgenza
ELISA e Immunofluorescenza
-
Consentono distinzione delle classi di anticorpi (IgM vs. IgG)
-
Permettono profilo anticorpale qualitativo e quantitativo
-
Permettono diagnosi anche con un singolo campione di siero
-
Sono le tecniche attualmente preferite
Limitazioni dei Test Sierologici
-
Falsi negativi nei primi 5 giorni di malattia
-
Reattività crociata con altri Alphavirus (O’nyong-nyong, Sindbis virus)
-
Difficile diagnosi differenziale precoce con Dengue e Zika virus in aree co-endemiche
Metodi Molecolari (Rilevazione dell’Acido Nucleico Virale)
Real-time RT-PCR (Reverse Transcription Polymerase Chain Reaction)
-
Gold standard per la diagnosi della fase acuta
-
Rileva il genoma virale nel siero e nei tessuti
-
Sensibilità: Massima durante i primi 7-10 giorni di malattia (fase viremica), periodo coincidente con l’esordio sintomaticopmc.ncbi.nlm.nih
-
Specificità: Elevata (>95%) con primer specifici
-
Vantaggio cruciale: Permette diagnosi negli stadi precoci quando gli anticorpi IgM non sono ancora presenti (giorni 1-5 di malattia)pmc.ncbi.nlm.nih
-
Requisiti: Reagenti preparati in laboratorio (kit commerciali limitati), necessita standardizzazione del metodo
-
Biosicurezza: Richiede laboratori con livello BSL-3 per la coltura virale
RT-PCR Nested
-
Aumenta sensibilità in campioni a basso titolo virale
-
Utile per fasi tardive della viremia
Ricerca Antigene Virale Rapida
-
Test antigenici rapidi in fase di sviluppo
-
Ancora non diffusamente disponibili
Isolamento Virale
-
Richiede laboratori di biosicurezza livello 3 (BSL-3)
-
Tempo prolungato (7-14 giorni)
-
Limitato ai laboratori di riferimento
-
Attualmente poco utilizzato per gestione clinica acuta
Strategie Diagnostiche e Timing Ottimale
Fase Acuta (Giorni 1-5 di Malattia)
-
Raccomandato: Real-time RT-PCR su siero
-
Alternativa: Ricerca di antigeni virali (ove disponibili)
-
Non raccomandato: Test sierologici IgM (alto rischio di falsi negativi)
Fase Post-Acuta (Giorni 5-10 di Malattia)
-
Raccomandato: Real-time RT-PCR (ancora positiva)
-
Raccomandato aggiunto: IgM ELISA o IFA (ora presumibilmente positiva)
-
Diagnosi più sicura: Combinazione di RT-PCR e IgM
Fase Convalescente (Dopo 10 giorni)
-
Raccomandato: IgM ELISA o IFA
-
Complementare: IgG ELISA o IFA (appare dalla settimana 2)
-
Diagnosi retrospettiva: Se non diagnosticata nella fase acuta
Diagnosis Differenziale
Data la sovrapposizione geografica e clinica con altre arbovirosi (Dengue, Zika, West Nile Virus, O’nyong-nyong), è essenziale:
-
Testare per Dengue (NS1 antigen ELISA, IgM, RT-PCR) contemporaneamente, poiché la co-infezione è possibile e presentava precedenza nel 2017-2024pmc.ncbi.nlm.nih
-
Considerare Zika virus in donne in gravidanza
-
West Nile Virus nei periodi epidemici autunnali in Europa
-
Malaria e altre febbri in aree co-endemiche
-
Differenziare da febbre reumatica acuta, lupus eritematoso sistemico, artrite reumatoide, sulla base di anamnesi, decorso, e test sierologici
Terapia e Gestione Clinica
Principi Generali del Trattamento
Non esiste al presente nessun antivirale specifico efficace contro il virus della Chikungunya. La terapia è quindi interamente sintomatica e di supporto, mirata a ridurre i sintomi acuti e cronici, promuovere il riposo, e prevenire complicanze.ncbi.nlm.nih
Fase Acuta
Raccomandazioni WHO e Linee Guida Internazionalincbi.nlm.nih
1. Riposo Assoluto
-
Fondamentale per accelerare la ripresa
-
Consigliato fino a risoluzione della febbre e miglioramento significativo dell’astenia
2. Reidratazione
-
Idratazione orale: Acqua, bevande ricche di sali minerali, succhi di frutta diluiti
-
Idratazione infusiva (IV): Indicata in pazienti con difficoltà di assunzione orale, vomito persistente, segni di disidratazione. La reidratazione infusiva abbondante accelera la riduzione della febbre, del dolore, e facilita la ripresa energetica dell’organismoepicentro.iss
-
Composizione ottimale: Soluzione fisiologica (NaCl 0.9%), reintegro di sali (potassio, sodio, magnesio) e lattato
-
Monitoraggio: Bilancio idroelettrolitico, funzionalità renale (creatinina, urea)
3. Controllo della Febbre e del Dolore
La gestione del dolore è cruciale, poiché il dolore articolare incapacitante rappresenta la manifestazione predominante.
First-line (Raccomandato)
-
Paracetamolo (Acetaminofene): 500-1000 mg ogni 6-8 ore, massimo 4 g/die
-
Efficace per febbre e dolore
-
Profilo di sicurezza migliore
-
Evitare sovradosaggio (epatotossicità)
Non raccomandato inizialmente (Prime 48 Ore)
-
Acido Acetilsalicilico (Aspirina) e Farmaci Antinfiammatori Non Steroidei (FANS): SCONSIGLIATI nelle prime 48 ore per rischio di aggravamento della disfunzione piastrinica, particolarmente in caso di co-infezione con Dengue o altre arbovirosi emorragichencbi.nlm.nih
-
Dopo le prime 48 ore, FANS a basso dosaggio (ibuprofene 400-600 mg ogni 6-8 ore) possono essere considerati se disponibili e tollerati
Fase Post-Acuta e Cronica
Antinfiammatori Non Steroidei (FANS)
-
Ibuprofene 400-600 mg 2-3 volte al giorno
-
Naprossene 250-500 mg 2 volte al giorno
-
Utili per ridurre infiammazione articolare persistente
Corticosteroidi
-
Corticosteroidi a basso dosaggio: Dimostrato efficace nei primi 2 mesi di malattia post-acuta per ridurre infiammazione e accelerare la ripresancbi.nlm.nih
-
Prednisone 20-30 mg al giorno per 1-2 settimane, poi riduzione graduale
-
Indicati particolarmente nei pazienti con astenia severa e dolore incapacitante
Farmaci Antireumatici Modificanti la Malattia (DMARDs)
-
Idrossiclorochina: 200-400 mg al giorno, ha mostrato efficacia nella poliartralgia e poliartrite cronica ricorrente/remittentencbi.nlm.nih
-
Combinazione di idrossiclorochina + corticosteroidi o altri DMARDs
-
Indicata per manifestazioni croniche persistent oltre 3 mesi
-
Sulfasalazina, metotrexato in casi refrattari
Farmaci Immunosoppressori
-
Considerati in rari casi di malattia cronica severa non responsiva a altre terapie
-
Necessita valutazione specialistica reumatologica
Supporto Sintomatico Supplementare
Glutatione
-
Ha dimostrato utilità per accelerare la fase di ripresa
-
Riduce lo stress ossidativo
Nutrizione e Integrazione
-
Dieta ricca di antiossidanti, vitamine (particolarmente B, C, D)
-
Integrazione di micronutrienti (zinco, selenio) per supportare la risposta immunitaria
-
Proteine adeguate per prevenzione della sarcopenia da immobilità
Fisioterapia e Riabilitazione
-
Fase acuta: Riposo e immobilità relativa
-
Fase post-acuta: Esercizi di mobilizzazione passiva e attiva dolce iniziati quando tollerati
-
Fase cronica: Fisioterapia strutturata per mantenersi funzione, ridurre rigidità articolare, prevenire atrofia muscolare
-
Importante per tutti i pazienti con artralgia persistente
Infezione Nosocomiale in Pazienti Viremiaci
Protezione dai Vettori nelle Aree Endemiche
Nelle aree endemiche e dove si manifestano epidemie o casi sporadici, tutti i pazienti affetti da febbre Chikungunya dovrebbero essere protetti da punture degli insetti vettori (zanzare) per evitare che le zanzare si infettino e propaghino l’infezione.
Gestione della Malattia Cronica Persistente
Data la frequenza e l’impatto della malattia cronica postacuta:
-
Monitoraggio a lungo termine: Valutazione clinica a 3 mesi, 6 mesi, 1 anno post-infezione
-
Coinvolgimento multidisciplinare: Medici di medicina generale, reumatologi, fisioterapisti, psicologi (per depressione/ansia correlate)
-
Educazione del paziente: Aspettative realistiche sulla durata e sulla progressione della malattia, aderenza alla terapia
-
Supporto socio-lavorativo: Aggiustamenti lavorativi, congedi medici appropriati data l’incapacità funzionale
Ricerca di Terapie Antivirali Innovative
Sebbene non ancora approvate per uso umano, sono in fase di sperimentazione:
-
siRNA targeting virale: Bloccaggio selettivo della replicazione virale
-
Inibitori della replicazione/entrata virale: Targeting di nsP2 (proteasi), proteine di superficie E1-E2
-
Monoclonali neutralizzanti e immunoterapia cellulare: In fase preclinica
Questi approcci rappresentano prospettive future per la terapia specifica della Chikungunya.
Prevenzione
Prevenzione Individuale e Comportamentale
La prevenzione della Chikungunya si basa primariamente sull’evitamento della puntura di zanzare, dato il vettore biologico della trasmissione.
1. Abbigliamento Protettivo
-
Indumenti di colore chiaro: I colori scuri e accesi attraggono gli insetti
-
Copertura corporea: Maniche lunghe e pantaloni lunghi che coprano la maggior parte del corpo
-
Trattamento degli indumenti: Spray insetticidi permetrina-based applicati agli abiti (non sulla pelle)
2. Evitare Profumi e Fragranze
-
I profumi e le fragranze attraggono gli insetti
3. Sistemazione Notturna Protetta
-
Camere con condizionamento d’aria: Ideale, poiché l’attività di Aedes è ridotta in ambienti freddi
-
Zanzariere alle finestre e porte: Tenute in buone condizioni, chiuse costantemente
-
Zanzariere sul letto: Impregnate possibilmente con insetticidi permetrina, con margini ben rimboccati sotto il materasso
-
Ispezione: Verificare assenza di zanzare all’interno prima di coricarsi
4. Insetticidi Ambientali
-
Zampironi (spirali antizanzare): Disponibili in commercio
-
Spray insetticidi: A base di piretro o permetrina
-
Diffusori elettrici di insetticida: Funzionanti a corrente elettrica; verificare voltaggio locale
-
Precauzioni d’uso: Seguire scrupolosamente le istruzioni del foglio illustrativo, non applicare su mucose o aree cutanee lese, prestare attenzione particulare all’uso in bambini
5. Repellenti Cutanei
-
DEET (N,N-diethyl-m-toluamide):
-
Concentrazione 20-30% efficace per adulti e bambini >2 mesi
-
Concentrazione 10% per bambini 2-12 mesi (uso limitato)
-
Durata protezione: 4-6 ore a seconda della concentrazione
-
Riapplicare dopo bagni o sudorazione
-
Picaridin (1-piperidinecarboxylic acid, 2-(2-hydroxyethyl)-, 1-methyl propyl ester):
-
Concentrazione 20% efficace e ben tollerato
-
Profilo di sicurezza simile a DEET
-
Durata: 4-6 ore
-
Olio di Neem Compositum (Azadirachta indica + Corymbia citriodora):epicentro.iss
-
Prodotto naturale, multiuso, sicuro
-
Efficace anche per neonati, bambini, donne in gravidanza, soggetti con ipersensibilità
-
Indicato per coloro che preferiscono prodotti naturali anziché chimici
-
Grande efficacia come repellente da punture di zanzare, zecche, e altri parassiti
-
Utilizzo: Applicare su parti scoperte del volto, braccia, gambe, particolarmente nelle ore pomeridiane/notturne
-
Azione multipla: Antiparassitaria cutanea, antinfettiva (batteri, funghi, virus), protettiva cutanea, antieritema solare
-
Per informazioni: Contattare CESMET ([email protected], Tel. 06-39030481)
-
Olio di eucalipto limone (Eucalyptus citriodora):
-
Alternativa naturale al DEET
-
Efficace per 4-6 ore
-
Informazioni pratiche: Il sudore riduce l’effetto dei repellenti; riapplicare frequentemente, specialmente dopo attività fisica o bagni.
6. Orari di Esposizione
-
Aedes aegypti è attiva principalmente durante il giorno (alba e primissime ore del mattino, tardo pomeriggio)
-
Aedes albopictus è attiva principalmente tra tardo pomeriggio e alba
-
Limitare l’esposizione negli orari di picco
7. Eliminazione dei Siti di Riproduzione
-
Zanzare Aedes si riproducono in piccoli accumuli d’acqua stagnante: vasi, sottovasi, pneumatici, grondaie, scodelle per animali domestici
-
Eliminare regolarmente l’acqua stagnante dalle vicinanze
-
Coprire serbatoi d’acqua
-
Mantenere le aree circostanti prive di vegetazione densa
Prevenzione Vaccinale
Vaccino VIMKUNYA
Approvazione e Disponibilità
VIMKUNYA (Chikungunya Vaccine, Recombinant) è stato approvato dalla FDA il 14 febbraio 2025 con accelerated approval per persone di età ≥12 anni. È il primo vaccino contro la Chikungunya approvato globalmente.bavarian-nordic+1
Caratteristiche Virologiche
-
Piattaforma tecnologica: Vaccino VLP (Virus-Like Particles)
-
Struttura: Particelle simil-virali ricombinanti che mimano la struttura del virus Chikungunya senza capacità di infezione, replicazione, o causare malattiabavarian-nordic
-
Composizione: Adjuvanted recombinant CHIKV VLP vaccine
-
Formulazione: Dose singola di 1 mL in siringa di vetro pre-riempitabavarian-nordic
Immunogenicità ed Efficacia Clinica
Studi clinici di fase 3 hanno arruolato >3.500 individui sani di età ≥12 anni:bavarian-nordic
-
Immunogenicità: Al 21° giorno post-vaccinazione, VIMKUNYA ha indotto anticorpi neutralizzanti in fino al 97,8% dei vaccinatibavarian-nordic
-
Risposta immunitaria rapida: Inizio della risposta immunitaria entro una settimana dalla vaccinazione
-
Efficacia clinica: I trial hanno raggiunto gli endpoint primari, dimostrando protezione contro la malattia da Chikungunya
-
Profilo di sicurezza: Bene tollerato con effetti avversi prevalentemente miti-moderati
Profilo di Sicurezza e Effetti Avversi
In Pazienti di Età 12-64 Annivimkunyahcp+1
Effetti avversi sollecitati riportati entro 7 giorni dalla vaccinazione (percentuali >10%):
-
Dolore al sito di iniezione: 23,7%
-
Affaticamento: 19,9%
-
Cefalea: 18,0%
-
Mialgia: 17,6%
Effetti avversi moderati-gravi rare.
In Pazienti di Età ≥65 Annipharmacytimes+1
-
Dolore al sito di iniezione: 5,4%
-
Mialgia: 6,3%
-
Affaticamento: 6,3%
Profilo di sicurezza globalmente migliore nei pazienti anziani.
Dati di Sicurezza Real-World (al 3 Settembre 2025)pharmacytimes
-
No eventi avversi seri (SAEs): Nessuno segnalato a VAERS (Vaccine Adverse Event Reporting System)
-
No ospedalizzazioni o morti: Attribuite al vaccino
-
Segnalazioni: Tre eventi non-seri in due individui
Controindicazionicdc
-
Assolute: Storia di reazione allergica severa (es. anafilassi) a qualsiasi componente del vaccino
Precauzionicdc
-
Gravidanza: Dati limitati di sicurezza; consultare medico per valutazione rischio-beneficio
-
Allattamento: Dati limitati; valutare con medico
-
Età ≥65 anni: Precauzione generale (specialmente per vaccino live-attenuated alternativo); il vaccino VLP (VIMKUNYA) è preferibile agli anziani
-
Immunocompromissione: Pazienti in terapia immunosoppressiva possono avere risposta immunitaria diminuita; consultare medico
-
Sincope: Possibile in associazione con iniezioni; avere presidi medici pronti per gestione anafilassi
Indicazioni di Vaccinazione (CDC/ACIP 2025)cdc
-
Raccomandato: Persone di età 12 anni e oltre che viaggiano verso paesi/territori con outbreak di Chikungunya in corso
-
Può essere considerato: Persone di età 12 anni e oltre che viaggiano/si trasferiscono in paesi/territori senza outbreak attuale ma ad elevated risk, se pianificano soggiorno prolungato (≥6 mesi)
-
Vaccinazione VLP (VIMKUNYA): Preferibile ai vaccini live-attenuated (Ixchiq) particolarmente per persone ≥65 anni, immunocompromesse, donne in gravidanza
Vantaggi della Piattaforma VLP
-
Profilo di sicurezza superiore ai vaccini live-attenuated
-
Idoneo per immunocompromessi
-
Idoneo per donne in gravidanza/allattamento
-
Risposta immunitaria robusta e duratura
-
Dose singola
Limitazioni Attuali
-
Approvazione recente; dati a lungo termine su durata dell’immunità ancora in raccolta
-
Postmarketing requirement (PMR): Studio randomizzato doppio-cieco placebo-controllato per valutare efficacia, sicurezza, immunogenicità nel tempo
-
Pediatric study deferred: Valutazione di sicurezza e immunogenicità in bambini 2-<12 anni (submission finale febbraio 2028)
Vaccino Ixchiq (Live-Attenuated Vaccine) – NON PIU’ IN USO
IXCHIQ è il vaccino live-attenuated contro Chikungunya (CHIKV VLA).
Indicazioni: Persone di età ≥18 anni a rischio di esposizione
Precauzioni: Età ≥65 anni è una precauzione in base a investigazioni su segnalazioni di eventi avversi seri post-vaccinazione negli anziani. Tuttavia, il vaccino può ancora essere offerto se il beneficio della protezione supera i rischi. Valutazione medica necessaria.cdc
Consigli per Donne in Gravidanza e Persone con Malattie Croniche
-
Le donne in gravidanza dovrebbero chiedere consigli al proprio medico sull’opportunità di intraprendere viaggi in zone endemiche di Chikungunya, data la possibilità (anche se rara) di trasmissione congenita con manifestazioni neonatali gravi
-
Le persone con malattie croniche, anziani, immunocompromessi dovrebbero valutare il rischio-beneficio di viaggio in aree endemiche con il proprio medico
Sorveglianza e Monitoraggio Territoriale
In Europa e in Italia, è essenziale:
-
Monitoraggio attivo della presenza di casi di Chikungunya sul territorio nazionale per identificare tempestivamente, oltre ai casi importati, eventuali casi di trasmissione autoctona
-
Sorveglianza entomologica della densità e distribuzione di Aedes albopictus e della sua carica virale
-
Sorveglianza sierologica periodica in aree a rischio
-
Misure di controllo vettoriale: Spruzzamenti insetticidi in focolai attivi, bonifica di siti di riproduzione
Considerazioni Commerciali e di Viaggio
Al momento non ci sono evidenze che indichino di limitare gli scambi commerciali e i viaggi nelle zone endemiche per Chikungunya, considerando:
-
Il numero limitato di casi importati in Europa
-
La non-severità del quadro clinico nella popolazione generale
-
L’assenza di trasmissione locale stabile in Europa (eccetto per gli episodi 2005-2007 in Italia e 2025 in Francia-Italia)
Tuttavia, categorie particolari (donne in gravidanza, persone con malattie croniche, immunocompromessi) dovrebbero ricevere counseling medico specifico.
Considerazioni Epidemiologiche Critiche e Epidemiologia Attuale 2025
Genotipi Virali e Variazioni
Tre genotipi principali circolano globalmente:
-
ECSA (East/Central/South African): Storicamente associato all’Africa e all’Oceano Indiano; emergente nelle Americhe nel 2025, particolarmente in Sud America
-
Asiatico: Dominante in Asia; emergente nelle Americhe
-
West African: Circola principalmente in Africa occidentale
Le variazioni genetiche influenzano:
-
La competenza vettoriale
-
La virulenza clinica
-
La trasmissibilità
Coinfezioni con Dengue e Zika
In aree co-endemiche (particolarmente Asia, Africa, Americhe), la coinfection con Dengue e/o Zika è possibile (prevalenza riportata 2,7-12,4%). I pazienti coinfetti:pmc.ncbi.nlm.nih
-
Presentano quadro clinico più severo
-
Hanno aumentato rischio di manifestazioni neurologiche severe
-
Mostrano maggiore incidenza di stroke/TIA (17% vs. 6% in monoinfection)thelancet
-
Richiedono diagnosi differenziale attenta e contemporanea ricerca di tutti i virus
Sottostima Epidemiologica Globale
La vera incidenza globale di Chikungunya è sottostimata per:
-
Casi lievi e paucisintomatici che non vengono diagnosticati
-
Alta percentuale di portatori sani asintomatici del virus
-
Mancanza di test diagnostici nei paesi endemici tropicali (assenza di kit diagnostici)
-
Diagnosi clinica difficile (tutti i casi febbrili vengono etichettati come “malaria” o “tifo” in molti sistemi sanitari tropicali)
-
Modelli predittivi attuali suggeriscono che 14,4 milioni di persone globalmente potrebbero essere a rischio annualmente, con potenziale espansione a 34,9 milioni con futura diffusionemedicalxpress
Impatto Socio-Economico
La Chikungunya causa:
-
Perdita di produttività lavorativa durante fase acuta (incapacità funzionale)
-
Perdita cronica di produttività in pazienti con artralgia persistente
-
Impatto psicosociale (depressione, ansia, alterata qualità della vita)
-
Costi sanitari per ospedalizzazione, test diagnostici, terapie
-
Impatto economico su turismo e commercio in aree endemiche
Paesi e Aree Geografiche di Maggior Rischio Epidemiologico
Africa (Endemica e Co-Endemica)
-
Sahel africano: Senegal, Gambia, Burkina Faso, Mali
-
Africa Orientale: Kenya, Somalia, Tanzania
-
Africa Centrale: Repubblica Centrafricana, Congo
-
Isole Africane e Oceano Indiano:
-
Madagascar: Ongoing transmission, 2024-2025
-
Mauritius/Maurizio: Ongoing transmission
-
Mayotte (Francia): Ongoing transmission
-
Seychelles: Endemic with periodic outbreaks
-
La Réunion (Francia): Endemic dal agosto 2024, >47.000 casi confermati al maggio 2025, trasmissione sostenuta
Asia e Sud-Est Asiatico (Endemici)
-
India: Endemica, 5,1 milioni di persone a rischio annualmente secondo modelli predittivi; focolai periodici
-
Sri Lanka: Endemica, ricrudescenza 2024-2025 (151 casi novembre 2024-marzo 2025)
-
Bangladesh: Endemica, casi intermittenti
-
Thailand: Endemica
-
Malaysia: Endemica
-
Indonesia: Endemica, 2.974 casi nel 2022
-
Filippine: Endemica
-
Singapore: Endemica con bassa incidenza
-
Myanmar: Endemica
-
Laos: Endemica
-
Cambodia: Endemica
-
Vietnam: Endemica
Oceano Indiano (Endemico)
-
Maldive: Endemica, outbreak 2024-2025
-
Isole dei Caraibi Francesi: Ongoing transmission
Americhe (Emergente e In Espansione 2024-2025)
Sud America
-
Bolivia: Epidemia in corso 2024-2025, uno dei focolai più grandi delle Americhe
-
Brasile: Epidemia sustanuta 2024-2025, con >200.000 casi, genotipi asiatico e ECSA
-
Paraguay: Epidemia in corso 2024-2025, espansione a aree precedentemente incolpite
-
Argentina: Trasmissione autoctona dopo anni di assenza, reemergenza 2024-2025
-
Perù: Trasmissione locale 2024-2025, integrazione con epidemia amazzonica
-
Colombia: Trasmissione autoctona
America Centrale e Messico
-
Messico: Casi sporadici e piccoli focolai
-
Costa Rica: Trasmissione autoctona
-
Belize: Trasmissione autoctona
-
Guatemala: Trasmissione autoctona
-
Honduras: Trasmissione autoctona
-
Panama: Trasmissione autoctona
Caraibi
-
Repubblica Dominicana: Epidemia storica
-
Porto Rico: Trasmissione autoctona storica e ricorrente
-
Isole Vergini Americane: Trasmissione autoctona
-
Antigua e Barbuda: Trasmissione autoctona
-
Barbados: Trasmissione autoctona
-
Dominica: Trasmissione autoctona
-
Grenada: Trasmissione autoctona
-
Guadeloupe (Francia): Trasmissione autoctona
-
Martinica (Francia): Trasmissione autoctona
-
Saint Lucia: Trasmissione autoctona
-
Saint Vincent e Grenadine: Trasmissione autoctona
Nord America
-
USA – Florida: Trasmissione locale limitata (focolai sporadici)
-
USA – Porto Rico: Trasmissione locale ricorrente
Bacino del Mediterraneo e Europa 2024-2025 (NEW – AUTOCTONA)
-
Francia: 734 casi confermati al 19 ottobre 2025, con 54 cluster (40 attivi), trasmissione sostenuta nelle aree rivierasche mediterraneevax-before-travel+1
-
Italia: 364 casi confermati al 19 ottobre 2025, principalmente in Emilia-Romagna (Ravenna, Modena, Bologna, Forlì-Cesena), con trasmissione autoctona stabile in quattro cluster (tre attivi). Distribuzione: Carpi, San Prospero, Soliera, Novellara, Cavezzo, Modena, Nonantola, Correggio, Novi di Modena, Cesenaticowho+1
-
Spagna: Caso isolato (monitorato)
-
Portogallo: Nessun caso endemico riportato
-
Grecia: Nessun caso endemico riportato
Cina e Giappone
-
Cina: Endemica in aree sud/sud-est (Guangdong, Guangxi)
-
Giappone: Caso isolato sporadico
Australia e Oceania
-
Australia: Rara, casi di importazione
-
Papua Nuova Guinea: Endemica
-
Nuove Ebridi (Vanuatu): Endemica
-
Samoa: Endemica
-
Isole Cook: Endemica
Ranking di Rischio per il Viaggiatore
Altissimo Rischio (Epidemia attiva, alta trasmissione):
-
Bolivia, Brasile, Paraguay, Sri Lanka, La Réunion, Francia (2025), Italia (2025)
Alto Rischio (Endemico con epidemie periodiche):
-
India, Indonesia, Kenya, Argentina
Rischio Moderato (Endemico con trasmissione sporadica):
-
Thailand, Malaysia, Filippine, Bangladesh, Senegal, Somalia, Mauritius, Seychelles
Rischio Basso (Rari focolai, casi sporadici):
-
USA (Florida, Porto Rico), Messico, Singapore, Giappone, Australia
Per uno sguardo d’insieme, rapido ma esplicativo, guarda anche il nostro video su You Tube
Bibliografia Aggiornata (Novembre 2025)
-
Clinica del Viaggiatore CESMET. (2023). Chikungunya – Scheda malattia. https://www.clinicadelviaggiatore.com
-
European Union Climate-Adapt Platform. (2025). Chikungunya | Malattie infettive. https://climate-adapt.eea.europa.eu
-
Istituto Superiore di Sanità – epiCentro. (2025). Chikungunya. https://epicentro.iss.it
-
MSD Manuals. (2025). Chikungunya – Malattie infettive. https://www.msdmanuals.com
-
Medico e Bambino. (2005). Chikungunya: primo focolaio epidemico italiano di una malattia. https://www.medicoebambino.com
-
Bavarian Nordic. (2025, March 17). Bavarian Nordic Announces Commercial Launch of Chikungunya Vaccine (VIMKUNYA). https://www.bavarian-nordic.com
-
WHO. (2025, June 10). Global Chikungunya Epidemiology Update. https://cdn.who.int
-
CDC. (2025, February 14). Approval Letter – VIMKUNYA – FDA. https://www.fda.gov
-
HealthyTravel.ch. (2025, March 13). Factsheet Febbre Chikungunya. https://healthytravel.ch
-
NIH/NCBI. (2025, June 25). Diagnostic Utility of Real-Time RT-PCR for Chikungunya Virus. https://www.pmc.ncbi.nlm.nih.gov
-
Vax-Before-Travel. (2025, October 18). Chikungunya Cases Spike in France and Italy. https://www.vax-before-travel.com
-
NCBI StatPearls. (2023, June 25). Chikungunya Fever – Treatment/Management. https://www.ncbi.nlm.nih.gov
-
Science Magazine. (2022, December 27). Molecular Architecture of the Chikungunya Virus Replication Complex. https://www.science.org
-
WHO. (2025, October 2). Chikungunya Virus Disease – Global Situation. https://www.who.int
-
NICD South Africa. (2025, August 11). Update on Chikungunya Fever. https://www.nicd.ac.za
-
NIH/NCBI. (2016, December 14). Laboratory Diagnosis of Chikungunya Virus Infections. https://www.pmc.ncbi.nlm.nih.gov
-
PLOS Journals. (2025, February 2). Clinical Manifestations Associated with the Chronic Phase of Chikungunya Fever. https://www.journals.plos.org
-
Vax-Before-Travel. (2023, October 8). Chikungunya Outbreaks – Africa and Global Distribution. https://www.vax-before-travel.com
-
VIMKUNYA Healthcare Provider. (2025, February 24). Safety and Tolerability Information. https://www.vimkunyahcp.com
-
The Lancet. (2023). Neurological Disease in Adults with Zika and Chikungunya Virus Coinfection. https://www.thelancet.com
-
PMC/NIH. (2018, June 13). Increased Risk for Autochthonous Vector-Borne Infections Transmitted by Aedes albopictus in Europe. https://www.pmc.ncbi.nlm.nih.gov
-
Pharmacy Times. (2025, October 23). Early Real-World Experience with VIMKUNYA Consistent with Clinical Trials. https://www.pharmacytimes.com
-
Dr.Oracle. (2025, November 13). What is the Treatment for Chikungunya? https://www.droracle.ai
-
PMC/NIH. (2017, December 31). Coinfection of Chikungunya and Dengue Viruses – A Serological Study. https://www.pmc.ncbi.nlm.nih.gov
-
PMC/NIH. (2025, October 20). Clinical Outcomes of Chikungunya Across Age Groups – A Systematic Review. https://www.pmc.ncbi.nlm.nih.gov
-
Department of Health, Virgin Islands. Chikungunya – Clinical and Public Health Guidance. https://www.doh.vi.gov
-
Medical Express. (2025, September 30). India Could Bear Biggest Impact from Chikungunya – New Maps Suggest. https://www.medicalxpress.com
-
CDC. (2025, August 21). Chikungunya Vaccine Information for Healthcare Providers. https://www.cdc.gov
-
PAHO. (2025, November 12). Amid Localized Chikungunya Outbreaks and Ongoing Oropouche Emergence. https://www.paho.org
Nota per l’Utilizzo Clinico e Didattico
La presente scheda malattia è stata aggiornata a novembre 2025 ed incorpora le ultime indicazioni epidemiologiche, le nuove approvazioni vaccinali (VIMKUNYA), le linee guida diagnostiche internazionali e le raccomandazioni terapeutiche dell’OMS e dei principali enti di sanità pubblica (CDC, ECDC, ACIP). Rappresenta uno strumento di riferimento completo per medici tropicalisti, operatori di sanità pubblica, e professionisti della medicina di viaggio, e risulta conforme agli standard informativi della Clinica del Viaggiatore CESMET.










 plopia)
plopia) 



 –
– 