Consulenza con lo specialista
Se hai bisogno di informazioni o pensi di aver problemi di salute per questa malattia contatta la Clinica del Viaggiatore Cesmet.
Il centro medico Cesmet Clinica del Viaggiatore è specializzato in malattie infettive, tropicali e parassitologiche. Il dr. Paolo Meo, con esperienza più che trentennale in diversi continenti, soprattutto in diversi paesi africani, è a disposizione di chiunque necessità di un chiarimento o una visita specialistica.
Puoi recarti in ambulatorio, prenotando una visita compilando il modulo apposito o telefonando al numero 06 39030481.
Puoi anche richiedere un video-consulto da casa o dal tuo ufficio o ovunque ti trovi nel mondo collegandoti on line con lo specialista.
Cerca in questa pagina la consulenza che ti serve e prenotala, oppure chiama lo 06 39030481.
Introduzione e descrizione
L’epatite A è una malattia infettiva acuta, contagiosa, del fegato, a trasmissione alimentare, causata dal virus dell’epatite A (HAV). Le epatiti virali, conosciute ad oggi, sono cinque (A – B – C – Delta – E) più una, che ha caratteristiche cliniche e sierologiche molto particolari (epatite G). L’epatite A provoca una malattia acuta che nei bambini generalmente causa pochi sintomi e può anche passare inosservata, asintomatica. Questi soggetti sono però in grado di infettare gli altri individui. Negli adulti spesso è più acuta e si può manifestare anche in modo grave. Tra i sintomi l’ittero, la nausea, il vomito, la diarrea, non sempre la febbre ed il dolore addominale. La stanchezza può essere un sintomo importante e costringe il malato a letto per qualche settimana e a volte ha periodi di convalescenza piuttosto lunghi. Può raramente verificarsi un’insufficienza epatica acuta, evento più comune negli anziani e nei soggetti con deficit immunitari.
Si contagia per via oro-fecale, ossia mangiando o bevendo cibi o acqua contaminati da feci infette; oppure accostando alla bocca le mani non lavate o suppellettili contaminate con micro residui di feci. I molluschi crudi o poco cotti sono una fonte d’infezione relativamente comune. Ci si può infettare con HAV anche attraverso il contatto con una persona infetta, nel suo periodo di contagio, condividendo lo stesso bagno non applicando corrette misure di igiene, non facendo attenzione alla pulizia delle mani; oppure anche per via sessuale, attraverso rapporti sessuali oro-anali.
Dopo una infezione naturale, asintomatica o sintomatica, l’individuo acquisisce una immunità per il resto della sua vita. La vaccinazione contro il virus dell’ epatite A è efficace e previane la malattia. Alcuni paesi lo raccomandano di routine per i bambini e per gli individui a più alto rischio che non sono stati precedentemente vaccinati.
La somministrazione del ciclo del vaccino sembra mantenere la presenza di anticorpi per tutta la vita. E’ opportuno comunque per chi si reca in aree iperendemiche o per lavoro o adotta comportamenti a rischio effettuare periodicamente un richiamo, ogni 10 anni.
Tra le misure preventive efficaci, oltre la vaccinazione il lavaggio delle mani e la cottura dei cibi.
Non esiste un trattamento farmacologico specifico; generalmente vengono consigliati riposo, dieta e, a seconda delle necessità, l’assunzione di farmaci sintomatici contro la nausea e la diarrea. Le infezioni di solito si risolvono completamente e senza che vi sia un danno del parenchima epatico. In caso di insufficienza epatica acuta e generalizzata l’unico trattamento possibile è il trapianto di fegato.
I dati globali stimano in circa 2 milioni i casi sintomatici annui; le infezioni sono stimate in diverse decine di milioni.
La malattia è più comune nelle aree tropicali ed equatoriali e nei paesi con scarsità di norme igieniche e con la difficoltà ad accedere a fonti d’acqua non contaminate.
Nella aree tropicali e depresse e nelle grandi metropoli circa il 90% dei bambini rimangono infettati prima dei 10 anni con una immunità che dura in età adulta. La mortalità è relativamente bassa.
Agente infettivo e ciclo vitale
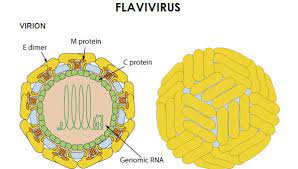
Il virus dell’epatite A (HAV) – genere Hepatovirus – famiglia Picornaviridae, è un virus a RNA. E’ un virus privo dell’involucro esterno “pericapside”. E’ invece costituito da un “capside di forma icosaedrica” dal diametro di 27 nm. Il capside è costituito da cinque polipeptidi (VP1, VP2, VP3, VP4 e VP5). Esiste un solo sierotipo. Il capside all’interno contiene un singolo filamento di RNA a polarità positiva costituito da 7.478 nucleotidi. Il virus HAV si lega tramite il “canyon” (una chiave di entrata) formato dalle proteine del capside al recettore che si trova sugli epatociti (cellule del fegato). Avvenuto il legame si modifica il capside con rilascio di VP4 e l’entrata del virus all’interno della cellula.
L’RNA virale (genoma) entra nella cellula bersaglio (epatocita) attraverso il canale venutosi a creare con l’adesione del polipeptide VP1 e il rilascio di VP4. L’RNA virale viene tradotto dai ribosomi in circa 10-15 minuti, cominciando a produrre polipetidi. La replicazione dell’RNA del virus coinvolge una RNA-polimerasi RNA-dipendente virale. La riproduzione delle parti dei nuovi virus è iniziata, e inizia anche l’assemblaggio delle particelle fino alla costituzione del nuovo virus.
L’RNA virale compete con l’mRNA cellulare per l’attacco ai ribosomi bloccandone la traduzione. L’RNA fornisce le informazioni per formare all’interno della cellula i diversi polipeptidi che si assemblano formando il capside vuoto. Completata la replicazione dell’RNA virale, questo migra all’interno del capside di HAV così da formare il virione completo. E’ importante sapere che HAV, a differenza di altri picornavirus, non distrugge le cellule epatiche ma viene rilasciato dagli epatociti per esocitosi, ovvero per espulsione dalla parete cellulare.
Il capside di HAV è particolarmente resistente. Sopravvive infatti in sia in acqua dolce che in acqua salata. Resiste ai detergenti, sopporta temperature fino a 60 °C e ambienti a pH particolarmente acid.
HAV presenta come organo elettivo di replicazione il fegato, gli epatociti e viene eliminato con le feci, eliminazione che è massima nell’ultimo periodo di incubazione.
Trasmissione, porta di ingresso e incubazione
HAV si trasmette quasi esclusivamente per via oro-fecale, ossia attraverso l’ingestione di microparticelle fecali. L’ingestione di acqua o cibo contaminato è la causa più frequente di infezione. Il periodo delle piogge, nelle aree tropicali, il fenomeno della fecalizzazione del terreno, gli insetti che dopo essersi depositati su residui fecali infetti si depositano su cibi, contaminandoli; molluschi bivalvi come ostriche, vongole o cozze che filtrano acqua con residui fecali contenenti il virus possono essere veicolo di infezione soprattutto se mangiati crudi. E’ invece insolita la trasmissione parenterale (attraverso siringhe) mentre è possibile la trasmissione sessuale se uno dei partner è infetto con il virus ed il contagio avviene per microparticelle fecali (oro-fecale).
HAV una volta ingerito penetra attraverso l’epitelio orofaringeo o intestinale, superando facilmente la barriera acida gastrica (è molto resistente fino ad un PH 1.), nel la microcircolazione e quindi al torrente circolatorio. Attraverso l’endotelio dei capillari sottomucosi il virus entra nel sangue e giunge nel fegato. HAV attraverso i capillari degi acini epatici fuoriesce dal torrente ematico e si lega agli epatociti o alle cellule di Kupffer (macrofagi specializzati localizzati nel fegato, che fanno parte del “sistema dei macrofagi” – sistema reticoloistiocitario o sistema reticoloendoteliale). Il virus, attraverso il “sistema a chiave” precedentemente descritto, penetra nel citoplasma e comincia a replicare utilizzando i ribosomi della cellula. I virioni completi e attivi (il nuovo virus) una volta prodotto viene espulso dall’epatocita per esocitosi nella bile per essere poi eliminato con le feci.
Il virus si ritrova nelle feci già cinque giorni prima della comparsa dei sintomi e delle alterazioni metaboliche riscontrabili con gli esami di laboratorio, e si ritrova infetto fino a dieci giorni dopo l’esordio dei sintomi. Nei pazienti immunodepressi la eliminazione virale può prolungarsi oltre i 6 mesi dopo l’esordio della malattia.
Distribuzione geografica
Aree iperendemiche si ritrovano in quasi tutti i continenti. In particolare nelle aree subsaheliane dell’Africa, nel sud-est asiatico, in America del Sud, nel bacino del mediterraneo e l’est europeo.
Tradizionalmente vengono descritte 3 categorie geografiche di endemicità correlate alla prevalenza di HAV e categorie di rischio comportamentale:
- aree ad alta endemicità (paesi a basso e medio reddito), con scarse condizioni igienico-sanitarie. Le infezioni si manifestano soprattutto nei bambini sotto i 10 anni e sono spesso asintomatiche. In queste zone solitamente non si manifestano epidemie di HAV poiché adolescenti e adulti sono immuni dalla loro infanzia e costituiscono, con le loro difese immunitarie, una barriera alla diffusione dell’infezione;
- aree ad endemicità intermedia, (Paesi a medio reddito) con condizioni igienico-sanitarie variabili. In queste zone l’infezione si manifesta soprattutto negli adulti e si possono verificare anche importanti epidemie;
- aree a bassa endemicità, (Paesi industrializzati) con buone condizioni igienico-sanitarie che frenano la diffusione del virus. In questi Paesi l’infezione colpisce maggiormente gli adolescenti e gli adulti. I principali fattori di rischio sono rappresentati dai viaggi internazionali in zone endemiche e dal consumo di alimenti (soprattutto frutti di mare) o acqua contaminati.
- soggetti appartenenti a gruppi a rischio, come chi fa uso di droghe per via endovenosa e omosessuali (“man who have sex with men” – MSM), soggetti con quadri di immunodepressione. Aree ad alta prevalenza di HIV
Secondo i dati statistici di eCDC in Europa l’incidenza dell’infezione varia ciclicamente con picchi di malattia ogni 10-15 anni. ECDC nel 2018 riporta 15.677 casi confermati di epatite A nell’Unione Europea, con predominanza di casi tra la popolazione maschile (57,2% uomini vs 42,8% donne). La fascia d’età più colpita continua ad essere quella compresa tra i 5 ed i 14 anni.
Sintomi
I sintomi sono prevalentemente gastrointestinali. Frequente la febbre; importante astenia che aumenta nel tempo; artralgie e dolori generalizzati. L’ ittero è di durata variabile. L’infezione al di sotto dei due anni d’età difficilmente evolve in malattia evidente, ma le forme sono quasi sempre inapparenti.
L’infezione acuta da HAV è caratterizzata nella prima fase da:
Malessere generale – Perdita dell’appetito – Nausea – Debolezza – Facile affaticabilità – Mal di testa – Dolori addominali non intensi e difficilmente localizzabili nella fase pre-itterica. A partire da 4-5 giorni prima della fase itterica si assiste a un’intensificazione della sintomatologia che invece migliora a partire dalla fase itterica.
Fase itterica: Ittero (la pelle e la sclera assumono un colore giallastro), urine scure, feci chiare, comparsa di prurito nella fase itterica.
I sintomi di solito appaiono da 2 a 6 settimane (periodo di incubazione) dopo l’infezione iniziale, con una media di 28 giorni.
Tra il 10-20% dei pazienti presentano un quadro di esordio simil-influenzale con febbre (da 37,7 a 38,3°C), mal di gola, raffreddore e tosse. Le urine tendono a diventare ipercromiche, cioè con una colorazione più intensa. In questi casi la sintomatologia è poco specifica, cioè non fa pensare immediatamente all’epatite, ma può essere confusa con molte altr malattie.
Fisiopatologia dell’epatite A
L’origine dei sintomi e della malattia sono da imputarsi prevalentemente alla forte risposta immunitaria dell’organismo contro il virus, prevalente negli organismi adulti. Difatti l’azione lesiva sulle cellule epatiche non deriva dall’azione diretta del virus, che una volta moltiplicato viene espulso dalla cellula con processo di “esocitosi” non lesivo per la cellula medesima. Ma invece la lesione cellulare e l’insorgenza dei sintomi derivano dalla abnorme reazione del sistema immunitario con l’induzione dei meccanismi dell’infiammazione che agiscono sulle cellule infette per distruggerle. Difatti il sistema immunitario combatte l’infezione da HAV tramite la secrezione di interferoni che hanno la funzione di limitare all’interno degli epatociti la replicazione virale. Viene anche indotto un processo di apoptosi, ossia della morte delle cellule epatiche indotta da linfociti NK e linfociti T-citotossici. Quindi una vera e propria morte degli epatociti causata dall’attacco delle cellule del sistema immune, con incremento anche elevato delle transaminasi. Il virus viene anche combattuto dalla presenza degli anticorpi, in particolare IgG e IgM e dal sistema del complemento mediante fenomeni di citotossicità cellulare anticorpo-dipendente. Gli anticorpi anti-HAV in seguito a un’infezione permangono a vita.
Diagnosi e trattamento
DIAGNOSI dell’epatite A
La reazione dell’organismo ad HAV danneggia le cellule epatiche che perdono la loro funzionalità di metabolizzare ed eliminare dall’organismo le tossine o i prodotti di scarto come la bilirubina. Con il progredire della patologia e l’apoptosi cellulare, la bilirubina e gli enzimi epatici aumentano nel sangue. La bilirubina e il pannello epatico costituito da transaminasi, fosfatasi alcalina e gamma GT forniscono informazioni sulle condizioni del fegato.
La ricerca degli anticorpi diretti contro HAV determina l’eziologia della malattia.
Esistono due differenti classi di immunoglobuline anti-epatite A: le IgM e le IgG. In seguito all’esposizione al virus HAV, l’organismo produce prima gli anticorpi IgM, che compaiono entro 2-3 settimane dal contagio precedendo spesso lo sviluppo dei sintomi. Queste persistono per 3-6 mesi.
Le IgG vengono prodotte dopo 1-2 settimane dalla comparsa delle IgM e persistono per tutta la vita. La ricerca degli anticorpi IgG anti-epatite A (IgG anti-epatite A) viene eseguita per distinguere un’infezione acuta da un’infezione pregressa. La positività delle IgG anti-epatite A suggerisce una precedente infezione da virus dell’epatite A prima oppure la presenza di immunità acquisita.
Se le IgM anti-epatite A sono positive, si pone diagnosi di epatite A acuta.
L’induzione delle IgG da vaccino ha generalmente una durata ridotta. Per questo motivo è importante un richiamo ogni 10 anni.
Ulteriori esami per l’epatite A comprendono albumina sierica, e il tempo di protrombina/rapporto internazionale normalizzato (INR).
TRATTAMENTO
Non esiste ad oggi un trattamento specifico per l’epatite A. Le forme lievi di solito si risolvono spontaneamente e non provocano danni permanenti al fegato. Viene normalmente prescritta una terapia di supporto che consiste nell’apporto di molti liquidi, importante glucosate ed anche Ringer Lattato.
Dieta leggera con assunzione di piccole quantità di cibo e bevande più volte al giorno.
HAV si può raramente manifestare con una forma potenzialmente letale, ossia l’epatite fulminante. Questa provoca insufficienza epatica tale da richiedere il ricovero ospedaliero. Negli anziani e nei soggetti con insufficienza epatica cronica tende ad essere più aggressiva. Le persone affette da epatite A acuta in queste condizioni devono essere monitorate con grande attenzione.
Controllo, trasmissione e vaccinazione
L’infezione da HAV si previene con il vaccino che è fortemente raccomandato alle persone a rischio complicanze, incluse le persone con patologie croniche del fegato e pazienti con lesioni epatiche riconducibili ad altre cause. Importante la vaccinazione per chi fa uso di droghe e per coloro con rapporti sessuali non protetti (micro particelle fecali). Fortemente raccomandato il vaccino per chi affronta viaggi internazionali.
VEDI LA SCHEDA VACCINAZIONE PER EPATITE A
L’epatite A può essere prevenuta con una corretta igiene, che prevede il lavaggio delle mani dopo l’uso del bagno, dopo aver cambiato un pannolino e prima di mangiare o di cucinare. Attenzione ai cibi contaminati e crudi.
Oltre la vaccinazione, il viaggiatore che si reca in Paesi ad alto rischio dovrebbe rispettare alcune semplici regole, come lavare abbondantemente verdura e frutta, e sbucciare quest’ultima prima di mangiarla. Mangiare carne e pesce, in modo particolare i molluschi, soltanto dopo una attenta cottura. Non lasciar passare troppo tempo dalla cottura.
Un altro importante veicolo di infezione dell’epatite A è l’acqua; quella di rubinetto o di sorgenti comuni deve essere bollita per almeno 10 minuti. L’acqua in bottiglia può essere consumata a patto che la bottiglia venga aperta sotto i propri occhi. Attenzione al ghiaccio, che non andrebbe mai consumati direttamente o aggiunto alle bevande. Una attenzione particolare a non lavarse denti con acqua del rubinetto. Anch’essa dovrebbe essere di bottiglia. Allo stesso modo, quando si fa il bagno in fiumi e mari è bene prestare attenzione che non entri dell’acqua in bocca.
Ricapitolando una buona prevenzione personale dell’epatite A si ottiene adottando con le comuni norme di igiene come l’accurato e frequente lavaggio delle mani, dopo essere stati alla toilette e prima di manipolare gli alimenti. Oggetti come spazzolini, posate, bicchieri ed asciugamani devono essere di utilizzo strettamente personale.
Per tutte queste innumerevoli vie di contagio è importante vaccinarsi prima della partenza, per viaggio o per lavoro, nelle zone a rischio.
La prevenzione generale dell’epatite A, molto efficace nei Paesi industrializzati, si attua dotando le abitazioni di un’adeguata rete fognaria e di un efficace sistema di raccolta e trattamento dei rifiuti; il tutto con lo scopo di evitare la contaminazione delle falde acquifere. Attenzione, pertanto, quando ci si reca in Paesi o regioni in cui i rifiuti si accatastano lungo le strade anziché in apposite discariche.
Notizie e bibliografia
- A.D.A.M. Medical Encyclopedia. Venipuncture. Updated April 26, 2019. Accessed July 12, 2021.
- A.D.A.M. Medical Encyclopedia. Hepatitis A – children. Updated January 1, 2020. Accessed July 12, 2021.
- A.D.A.M. Medical Encyclopedia. Hepatitis A. Updated January 12, 2020. Accessed July 12, 2021.
- A.D.A.M. Medical Encyclopedia. Hepatitis virus panel. Updated October 29, 2020. Accessed July 12, 2021.
- ARUP Consult. Hepatitis A virus. Updated April 2021. Accessed July 12, 2021.
- ARUP Consult. Acute viral hepatitis. Updated April 2021. Accessed July 12, 2021.
- Centers for Disease Control and Prevention. Hepatitis A. Updated July 1, 2019. Accessed July 12, 2021.
- Centers for Disease Control and Prevention. Vaccine (shot) for hepatitis A. Updated August 2, 2019. Accessed July 12, 2021.
- Centers for Disease Control and Prevention. Hepatitis A. Updated June 22, 2020. Accessed July 12, 2021.
- Centers for Disease Control and Prevention. Hepatitis A Questions and answers for the public. Updated July 28, 2020. Accessed July 12, 2021.
- Centers for Disease Control and Prevention. Hepatitis A vaccine What you need to know. Updated July 28, 2020. Accessed July 12, 2021.
- Centers for Disease Control and Prevention. Hepatitis A. Questions and answers for health professionals. Updated July 28, 2020. Accessed July 12, 2021.
- Centers for Disease Control and Prevention. General best practice guidelines for immunization: Special situations. Updated May 4, 2021. Accessed July 12, 2021.
- Chopra S, Lai M. Hepatitis A virus infection: Treatment and prevention. In: Leder K, Rand EB, eds. UpToDate. Updated September 16, 2020. Accessed July 12, 2021.
- Kumar S. Hepatitis A. Merck Manual Professional Edition. Updated December 2020. Accessed July 12, 2021.
- Kumar S. Overview of acute viral hepatitis. Merck Manual Consumer Edition. Updated January 2021. Accessed July 12, 2021.
- Kumar S. Overview of chronic hepatitis. Merck Manual Consumer Edition. Updated January 2021. Accessed July 12, 2021.
- Kumar S. Hepatitis A. Merck Manual Consumer Edition. Updated January 2021. Accessed July 12, 2021.
- Lai M, Chopra S. Patient education: Hepatitis A (beyond the basics). In: Hirsch MS, ed. UpToDate. Updated September 21, 2020. Accessed July 12, 2021.
- Lai M, Chopra S. Hepatitis A virus infection in adults: Epidemiology, clinical manifestations, and diagnosis. In: Hirsch MS, ed. UpToDate. Updated July 8, 2021. Accessed July 12, 2021.
- MedlinePlus: National Library of Medicine. Hepatitis testing. Updated July 6, 2016. Accessed July 12, 2021.
- MedlinePlus: National Library of Medicine. Hepatitis A. Updated October 12, 2016. Accessed July 12, 2021.
- MedlinePlus: National Library of Medicine. Hepatitis panel. Updated July 31, 2020. Accessed July 12, 2021.
- MedlinePlus: National Library of Medicine. What you need to know about blood testing. Updated March 9, 2021. Accessed July 12, 2021.
- National Heart, Lung, and Blood Institute. Blood tests. Date unknown. Accessed July 12, 2021. https://www.nhlbi.nih.gov/health-topics/blood-tests
- National Institute of Diabetes and Digestive and Kidney Diseases. Hepatitis A. Updated September 2019. Accessed July 12, 2021.
- Quirós-Tejeira RE. Overview of hepatitis A virus infection in children. In: Edwards MS, Rand EB, eds. UpToDate. Updated June 6, 2021. Accessed July 12, 2021.
- Samji NS. Viral hepatitis. Anand BS, ed. Medscape. Updated June 12, 2017. Accessed July 12, 2021.
- US Department of Veterans Affairs. Who and when to test for infection or immunity: Hepatitis A. Updated September 27, 2019. Accessed July 12, 2021.
- US Department of Veterans Affairs. Interpretation of Test Results: Hepatitis A. Updated September 27, 2019. Accessed July 12, 2021.
- US Food and Drug Administration. Hepatitis A virus (HAV). Updated March 29, 2019. Accessed July 12, 2021.