Consigli brevi per chi viaggia nel paese
Cosa devo fare quando vado in India?
L’India è un vero e proprio continente, il Sub Continente Indiano, formato da diversi Stati, ognuno amministrativamente autonomo. E’ un paese ricco di meravigliosi paesaggi, di ambienti diversi l’uno dall’altro. Popolato da oltre 1 miliardo di persone che si accalcano ovunque. Il viaggio è tutto da godere e da vivere. Devi proteggere la tua salute seguendo i consigli e preparando il viaggio adeguatamente.
In tutto il Sub Continente Indiano proteggiti dalle punture delle zanzare, portatrici di virus ed in alcune aree anche di malaria. Utilizza repellenti efficaci, anche naturali. Dengue, Chikungunija e altri virus sono presenti un pò ovunque, seguendo la stagionalità dei monsoni. La malaria è presente negli altopiani ma anche nelle grandi città. Durante la stagione monsonica, in diverse aree del paese proteggetevi dalla Encefalite Giapponese. Non è necessaria la vaccinazione contro la Febbre Gialla provenendo dall’Italia, dall’Europa e dal Nord America. Il virus della Febbre Gialla non è presente in Asia. Il virus SARS-CoV-2 continua a diffondersi con nuove varianti molto diffusive. Da sempre focolai di colera sono presenti anche nelle grandi città e diffusi in particolare durante il periodo dei monsoni. Consigliato il vaccino orale – DUKORAL.
Come faccio ad avere una informazione sanitaria corretta per andare in India?
Chiedi pure una consulenza per conoscere bene problemi e soluzioni – dottor Paolo Meo, medico tropicalista infettivologo

Alert sanitari
Quali sono le epidemie attuali in India?
MARZO 2023: COVID-19 – sottovariante ARTURO
La nuova variante di Omicron XBB.1.16 denominata Arturo dall’inizio del 2023 circola in oriente. In particolare in India la situazione è divenuta critica nel marzo 2023 dopo un mese di crescita esponenziale.
In tutto il mondo abbiamo assistito nei primi mesi del 2023 ad una diminuzione di casi di Covid, in particolare dei ricoveri in terapia intensiva ed anche dei decessi. Tutti noi abbiamo pensato che non avremo più sentito parlare di nuove varianti e nuove ondate. Ma non è così. L’ultima ondata della nuova variante Omicron arriva dall’India. Si chiama Arturo, dal nome di una delle stelle più luminose del firmamento. E’ del tipo Omicron (XBB.1.16) e ha fatto quadruplicare i contagi rispetto alla variante precedente, addirittura dal mese di febbraio 2023 quando questa ennesima variante di Omicron ha iniziato a circolare. Ora, per necessità, è scattata l’allerta in Europa e negli USA. Secondo OMS negli ultimi 28 giorni sono stati registrati quasi 3,6 milioni di nuovi casi di Covid con oltre 25 mila decessi in India. E i morti sono sempre tanti, nonostante l’aumento delle difese immuni determinate dalla diffusione del virus e dalle campagne di vaccinazioni. Si ritiene che i numeri descritti possano essere sottostimati per l’abbassamento della sorveglianza della pandemia in tutto il mondo. Il trend in ribasso sembra comunque essere confermato anche dai dati sui ricoveri: i report sulla pandemia a livello globale mostrano su un campione di 42 Paesi dal 20 febbraio al 19 marzo 2023 una riduzione del 9% dei nuovi ricoveri e del 5% degli ingressi in Terapia intensiva. Questi dati fotografano una situazione in cui poche persone effettuano i test per il Covid, nonostante sintomi respiratori. L’incidenza dei casi è sicuramente più ampia in chi mostra sintomi, senza recarsi in ospedale. In questo contesto di minore attenzione al Covid-19 giunge Arturo che diventa l’osservato speciale dell’OMS.
Si tratta di una ricombinante di BA.2.10.1 e BA.2.75 e condivide una mutazione (F486P) con XBB.1.5, a cui attualmente sono riconducibili il 45% delle sequenze depositate nel mondo.
Come le altre varianti più recenti di Omicron il virus ha imparato a eludere ancora maggiormente le difese immunitarie manifestando un aumento della trasmissibilità e maggiore patogenicità. Al momento, riferisce l’Oms, Arturo è stata segnalata in 21 Paesi. Ma non ci sono indicazioni di un aumento dei ricoveri, degli accessi in Terapia intensiva o dei decessi.
Per il momento non ci sono evidenze che Arturo possa causare forme d’infezione più gravi. Ma l’allerta e l’invito alla cautela da parte delle autorità sanitarie resta alto in tutto il mondo.
Quali sono i sintomi di Arturo?
Da quando Omicron ha iniziato a circolare, si sono moltiplicate le sue sotto varianti con grande rapidità. I sintomi che si presentano sono simili: le varianti Omicron colpiscono soprattutto le alte vie respiratorie con febbre, tosse e altri sintomi simil influenzali. Mai all’inizio della stagione primaverile si erano manifestati tanti casi di malessere respiratorio, anche se spesso piuttosto blando. Mal di testa, affaticamento, starnuti e mal di gola sono i sintomi dominanti.
Tutto questo è la conferma che il virus è molto instabile e che riesce a superare continuamente tutte le barriere messe in piedi dall’organismo a sua difesa. Questa caratteristica non si esaurirà in breve tempo, ma permetterà di creare nuove varianti in grado di schivare l’immunità e di mantenere alta la circolazione virale”.
MARZO 2023: CHIKUNGUNYA
Casi della febbre virale emorragica, particolarmente acuta, sono stati segnalati negli altopiani centro meridionali del Sub Continente Indiano. I casi sono continuati durante tutto l’anno dall’ottobre 2022 e si sono mantenuti per il persistere delle piogge durante la stagione invernale del 2022. La lotta alla zanzara, la protezione ambientale, l’utilizzo di repellenti efficaci e l’utilizzo delle zanzariere costituiscono la prima linea efficace di protezione.
MARZO 2023: MALARIA
L’innalzamento progressivo delle temperature e dell’umidità, dopo il periodo invernale fresco e con poche zanzare, porta all’aumento della diffusione della Anopheles con il propagarsi di malattie di origine parassitario (Plasmodio). Dopo un progressivo abbassamento di casi di malaria dal 2015 al 2019 e dopo 3 anni di pandemia Covid-19, in modo anomalo si è verificato un aumento di casi di malaria, anche mortali, in aree del paese ad altitudine superiore ai 1800 metri.
Nella regione dell’Asia sudorientale, per l’OMS, tre paesi continuano a rappresentare il 98% del totale dei casi segnalati nella regione. L’India con il 58% di casi rappresenta il primo paese dell’area, seguita dall’ Indonesia, con il 30% ed il Myanmar con il 10%. Secondo il WMR 2019, l’India rappresentava il 3% del carico globale della malaria nel mondo. Nel 2019, nonostante il paese mostrasse il più alto carico di malaria della regione SEA, mostrava anche una importante riduzione dei casi di malaria segnalati del 49% e dei decessi del 50,5% rispetto al 2017. I mancati controlli del territorio ed anche l’attenzione delle persone durante la pandemia ha contribuire a far nuovamente diffondere e crescere i casi di malaria nella maggior parte dei paesi. Sia nelle grandi pianure del nord che nelle grandi città, ma anche lungo gli altopiani centro meridionali ed in tutti i paesi rivieraschi.
Il fenomeno é presente ed è cresciuto nel triennio del Covid-19. Chi si reca in India deve informarsi delle aree di presenza della zanzara Anopheles, difendersi dalla puntura delle zanzare e non esporsi al rischio di puntura.
FEBBRAIO 2023: ADENOVIROSI – malattie respiratorie superiori. Mortalità elevata nei bambini fino a 9 anni.
Si mantiene elevato anche il numero dei casi di morbillo presenti nella maggior parte delle province del paese.
Clima, meteo salute e ambiente
Quale è il meteo e le previsioni del tempo a breve in India ?
Clicca qui per la situazione meteorologica e le previsioni a breve: Previsioni Meteo in tempo reale

Quali sono e come sono caratterizzate le diverse stagioni nel paese e come il clima influenza il diffondersi delle malattie in India?
L’India presenta diverse stagioni nell’arco dell’anno, cambiamenti climatici permettendo. Le principali stagioni, modificate da nord a sud del sub continente indiano, possono dividersi in: stagione invernale; stagione primaverile; stagione estiva; e la stagione monsonica (delle piogge).
Stagione invernale (novembre-febbraio): La stagione invernale in India è caratterizzata da temperature fredde e secche.
Gli stati settentrionali dell’India manifestano temperature molto basse, spesso sotto lo zero. I cieli sono limpidi e il clima è secco. In alcune regioni, come la valle del fiume Gange, la nebbia è un fenomeno tipico e comune durante l’inverno. Le temperature sono particolarmente rigide nel nord e nella regione pre-Hymalaiana ed Hymalaiana. Nella capitale New Delhi oscillano tra i 6 °C ed i 21 °C.
Gli stati centro meridionali dell’India mantengono situazioni di instabilità e temperature più miti ed umide.
Stagione primaverile (marzo-aprile): La stagione primaverile in India è caratterizzata da temperature piacevoli e clima secco. Il tempo migliora anche negli stati del sud. È una buona stagione, in genere, per visitare il paese, in quanto il clima generalmente è mite. La maggior parte dei territori è ancora verde dopo la stagione delle piogge.
Stagione estiva (maggio-giugno): La cosiddetta stagione estiva in India è caratterizzata dal cambio dei venti che cominciano a spirare dall’oceano verso i contrafforti Hymalaiani. Le temperature si alzano sempre di più ed il clima diventa caldo ma ancora secco. In alcune regioni, come lo stato del Rajasthan e le immense pianure del nord, le temperature possono raggiungere i 45°C. La stagione estiva non è favorevole per visitare la maggior parte degli stati indiani, in particolare del nord. Alcune regioni del centro e del sud del paese possono essere visitate durante questo periodo.
Stagione “monsonica” delle piogge (luglio- ottobre): E’ la stagione caratterizzata da forti piogge ed umidità molto elevata. Questa stagione è importante e necessaria per l’agricoltura e la maggior parte delle regioni dell’India diventa verde e lussureggiante. Le piogge possono essere causa di alluvioni e di frane in molte parti del paese.
La presenza di malattie, in particolare quelle trasmesse da insetti quali le zanzare, segue l’azione delle stagioni e della raccolta delle acque in acquitrini, dove la riproduzione degli insetti è condizionata dalla temperatura e dall’umidità.
Le regioni del centro sud mantengono le condizioni di riproduzione degli insetti, ed in particolare delle zanzare durante la maggior parte dei mesi dell’anno. L’area sud-orientale è spesso battuta, negli ultimi anni, da forti cicloni oceanici.
Nel Sub Continente Indiano la presenza di malattie, endemie ed il riaccendersi di focolai epidemici è legato alle diverse stagioni ed anche alla presenza di insetti e di animali, serbatoi di malattia, e ad eventi meteorologici particolarmente forti.
Nella stagione estiva, caratterizzata dal cambio dei venti, da alisei ai monsoni, con periodi di caldo estremo, in particolare al nord ed in diversi altopiani centrali del paese, le malattie più comuni sono caratterizzate da diarrea, inizio della diffusione dei focolai di colera, diffusione di malattie da microrganismi alimentari, quali febbre tifoide ed epatiti, colpi di calore e malattie cardio vascolari da calore, picchi di morbillo e varicella e diffondersi di alcuni tipi di meningite.
La stagione monsonica, in particolare all’inizio del periodo piovoso, è caratterizzata da malattie delle vie aeree superiori, con la crescita di tutte la malattie trasmesse da insetti vettori, ed in particolare dalle zanzare: Anopheles per la malaria. Sono nelle pianure del nord del paese, ma esistono anche focolai nella capitale New Delhi, negli altopiani centrali, nelle zone interne e costiere del sud del paese. I diversi tipi di Aedes vettori di arbovirosi quali Dengue e Chikungunya, sono presenti soprattutto nelle grandi città. Il serbatoio è l’uomo, e il fenomeno é in crescita esponenziale negli ultimi anni; l’insetto Culex per Encefalite Giapponese é presente nelle pianure del nord del paese, ma si é diffuso anche negli altopiani del centro-sud. Grave malattia non solo trasmessa da uccelli selvaggi da passo, ma anche da animali da cortile quali i maiali.
Durante la stagione monsonica sono in netto aumento le malattie da diffusione di microparticelle fecali o residui urinari quali Febbre Tifoide, Colera, Leptospirosi, l’epatite virale A e le infezioni gastrointestinali da enterobatteri o da virus intestinale.
Nella stagione invernale, in particolare al nord del paese, ci sono infezioni respiratorie virali e batteriche e le prime forme di influenza che giungono dalle aree dell’estremo oriente dell’Asia.
È essenziale adottare comportamenti di attenzione, e prepararsi portando farmaci adeguati, consigliati dagli esperti e dopo aver eseguito un giusto protocollo di vaccini a protezione della salute dell’organismo.
Quali conseguenza ha il cambiamento climatico sulle stagioni ed il clima dell’India?
Il cambiamento climatico sta avendo un impatto significativo sulle stagioni e sul clima dell’intero Sub Continente Indiano. Sta influenzando da tempo i cambiamenti delle stagioni con conseguenze sulla produzione agricola e sulla salute umana per l’aumento di malattie infettive, soprattutto a trasmissione da insetti. Secondo una ricerca commissionata dalla Banca Mondiale, l’India sta vivendo un clima sempre più caldo, in particolare nella stagione pre-monsonica, il che potrebbe portare a ondate di calore senza precedenti. I modelli di precipitazione ci danno aree di grave siccità con esaurimento delle risorse idriche sotterranee e cambiamenti nel flusso dei fiumi Indus, Gange e Brahmaputra [1], a cui seguono improvvisi uragani con inondazioni e distruzione completa dei raccolti. Inoltre, l’India è particolarmente vulnerabile all’aumento del livello del mare e agli eventi meteorologici sempre più frequenti e intensi. Il cambiamento climatico può anche aumentare il rischio di malnutrizione e disturbi correlati alla salute, come il nanismo infantile. La formazione di programmi come “Skill India” potrebbe addestrare 400 milioni di persone in settori tra cui lo sviluppo sostenibile.
Un esempio è l’inquinamento atmosferico a Nuova Delhi e Mumbay.
Nuova Delhi, Mumbay ed altre grandi città indiane stanno attraversando da diversi anni una situazione caratterizzata da livelli “gravi” di inquinamento atmosferico con presenza di inquinanti che hanno raggiunto una situazione di pericolo negli ultimi mesi. I fattori che contribuiscono includono, oltre ad un eccessivo uso di carburanti per i trasporti, alcuni periodi di festa religiosa con l’uso di petardi accesi durante le celebrazioni del Diwali; la “combustione stagionale” (ma spesso vietata) delle stoppie e le condizioni meteorologiche avverse. In risposta all’attuale situazione di pericolo l’Autorità per la prevenzione e il controllo dell’inquinamento ambientale per la regione della capitale nazionale di Delhi (NCR), ha dichiarato un’emergenza sanitaria pubblica per l’NCR. Ma l’inquinamnto rimane elevato in qualsiasi periodo dell’anno. Si consiglia ai viaggiatori che soffrono di malattie respiratorie croniche di prendere precauzioni ragionevoli per ridurre al minimo la loro esposizione a livelli elevati di inquinamento atmosferico.
Oltre a imporre misure che devono essere prese per combattere l’inquinamento a Delhi, le autorità consigliano a tutti , in particolare ai bambini, agli anziani e a coloro che sono altrimenti vulnerabili, di ridurre al minimo l’esposizione agli alti livelli di inquinamento, compresa la limitazione dell’esercizio fisico all’aperto, fino a quando i livelli di inquinamento diminuiscono.
 Consigli per i viaggiatori
Consigli per i viaggiatori
Si consiglia di prendere precauzioni ragionevoli per ridurre al minimo l’esposizione a livelli elevati di inquinamento atmosferico: limitare il tempo trascorso all’aperto; limitare l’esercizio fisico all’aperto.
Public Health England (PHE) consiglia l’utilizzo di mascherine per il viso adeguatamente adattata che può fornire una certa protezione. Le mascherine sono disponibili in India, ma è bene portarsele dai paesi di origine. Sono consigliate mascherine conformi agli standard UE P2 o P3 o agli standard statunitensi N95 o N98.
L’inquinamento atmosferico può colpire tutti, comprese le persone sane. L’esposizione a breve termine (ore o giorni) a livelli elevati di inquinanti atmosferici può provocare il peggioramento o l’aggravamento di malattie respiratorie, cardiache o del sistema circolatorio preesistenti. L’esposizione a lungo termine (anni o tutta la vita) all’inquinamento atmosferico riduce l’aspettativa di vita aumentando i decessi per malattie cardiache o circolatorie e respiratorie e per cancro ai polmoni.
Se hai condizioni preesistenti che potrebbero renderti più vulnerabile agli effetti dell’inquinamento atmosferico e stai viaggiando in aree in cui i livelli di inquinamento atmosferico sono elevati, dovresti discutere i tuoi piani di viaggio con il tuo medico, seguire le precauzioni per ridurre al minimo la tua esposizione e portare con te scorte adeguate delle tue medicine abituali.
Quali sono le caratteristiche dell’ambiente dell’india?
Il Sub Continente Indiano è un insieme di stati che condivide i confini con Cina, Nepal, Bhutan, Pakistan, Myanmar e Bangladesh.
La regione nord-orientale del paese è caratterizzata dalle immense catene montuose dell’Himalaya, la catena montuosa più alta del mondo. Qui si trovano alcune delle cime più alte, tra cui l’Everest e il K2. Nella regione dell’Himalaya, l’ambiente è caratterizzato da vette innevate, ghiacciai, valli fluviali profonde e pascoli alpini. Questa regione ospita una grande varietà di fauna, tra cui leopardi delle nevi, orsi tibetani, antilopi, yak e una vasta gamma di uccelli.
A sud dell’Himalaya si trova la grande pianura indo-gangetica, una delle pianure più fertili del mondo, attraversata da numerosi fiumi tra cui il Gange, il Brahmaputra e l’Indo. Questa regione è caratterizzata da terre coltivate, praterie, foreste di mangrovie e da numerose città e villaggi. Le pianure del Gange sono una delle regioni più fertili dell’India e producono una grande quantità di riso, grano e altri cereali. Questa regione è anche il luogo di pellegrinaggio per i fedeli indù, poiché il fiume Gange è considerato sacro e molte città sacre si trovano lungo il corso del fiume.
Ad ovest ci sono le montagne Aravalli e il deserto del Thar, i deserti del Rajasthan offrono un paesaggio unico di dune di sabbia, laghi di sale e una vasta gamma di fauna del deserto, tra cui cammelli, serpenti, uccelli e altri animali.
L’India centrale è una regione che si estende dalla catena montuosa dei Satpura a nord fino alla penisola indiana a sud. Questa regione è caratterizzata da una vasta gamma di ambienti naturali, tra cui foreste, praterie, laghi e fiumi. Le foreste di questa regione sono tra le più estese dell’India, con molte specie di piante e animali unici. La foresta di Satpura è una delle più grandi e ospita una vasta gamma di fauna selvatica, tra cui la tigre, l’orso, il leopardo e il cervo sambar. La regione ha anche numerose riserve naturali e parchi nazionali, tra cui il parco nazionale di Kanha e il parco nazionale di Pench, che sono famosi per la loro fauna selvatica.
La regione ha anche una vasta rete di fiumi, tra cui il Narmada, il Godavari e il Mahanadi. Questi fiumi forniscono acqua per l’agricoltura.
Le regioni meridionali dell’India sono caratterizzate da paesaggi diversi: dalle coste sabbiose alle colline verdeggianti e alle foreste lussureggianti, salendo sugli altopiani. La zona costiera della penisola indiana ospita diverse città, spiagge e parchi nazionali. Le spiagge del sud dell’India sono famose per la loro bellezza naturale e offrono attività come il nuoto, la pesca e il surf. La costa del Malabar è particolarmente famosa per le sue spiagge incontaminate e le bellezze naturali.
Le regioni collinari del sud dell’India sono note per la loro bellezza naturale, con molte città e villaggi situati sulle colline che offrono una vista panoramica sulla regione circostante. Le colline di Nilgiri, situate al confine tra il Tamil Nadu, Kerala e Karnataka, sono una delle principali attrazioni turistiche della regione.
L’India è caratterizzata da una grande diversità ambientale, grazie alla sua vasta estensione territoriale e alla sua posizione geografica. È presente una grande varietà di ecosistemi, dai deserti aridi alle foreste pluviali tropicali, dai fiumi ai monti. Enorme la varietà di flora e di fauna, con un’abbondante biodiversità.
Quali sono le malattie presenti in India? Quali sono i rischi reali (marzo 2023)
Quali le malattie presenti e quali le pratiche preventive e le vaccinazioni da fare per andare in India?
Sia l’OMS “Organizzazione Mondiale della Sanità” che i CDC americani “Centri per il Controllo e la Prevenzione delle Malattie” monitorano e segnalano costantemente le diverse malattie presenti in India.
C’è la Malaria in India?: (clicca qui) Il rischio di infezione esiste tutto l’anno in tutto il Paese, fatta eccezione per le aree ad altitudini >2500 metri. La maggior parte dei casi sono segnalati nelle aree di foresta negli stati di Madhya Pradesh, Maharashtra, Orissa, Gujarat, Rajasthan, Bihar e Karnataka. Le due specie principali in India sono Plasmodium vivax (50%) e P. falciparum (40%); P. malariae è stato riportato nell’India orientale (nello stato di Odisha) mentre P. ovale sembra essere estremamente raro se non del tutto assente.
C’è l’Encefalite Giapponese in India: Dal 2017, nello stato dei Maharashtra, sono stati confermati oltre 30 casi di Encefalite Giapponese. Da allora la tendenza è stata all’espansione dell’area di diffusione del virus e la sua capacità di adattarsi, anche in aree non endemiche. I casi si manifestano sempre di più in aree non endemiche.
Posso soffrire di Diarrea del viaggiatore in India?(clicca qui)
da ceppi ETEC (Enterotoxigenic E. coli). La diarrea del viaggiatore è tra le malattie più comuni durante i soggiorni in Kenya. Circa il 60% dei viaggiatori nel paese soffrono di queste fastidiose forme infettive intestinali. Può essere causata da vari agenti patogeni, tra cui batteri, virus e parassiti. Potrebbe essere opportuno l’utilizzo di alcuni farmaci in prevenzione.
C’è il Colera in India e come mi proteggo?: (clicca qui)
Il colera è una malattia infettiva acuta, presente con diversi focolai in molte parti del paese. Si è sviluppata attraverso acqua e cibo contaminati.
Esiste l’HIV/AIDS in India in caso di rapporti sessuali non protetti:
L’HIV/AIDS é un grave problema di salute pubblica nel paese. E’ importante fare attenzione ai rapporti sessuali con diversi partner casuali ed è raccomandata la protezione e l’utilizzo del preservativo.
Le arbovirosi come la Dengue, la Chikungunja o lo Zika sono presenti in India? (clicca qui)
Focolai di febbre dengue si verificano regolarmente in tutto il territorio Indiano, in particolare nel periodo pre monsonico, all’inizio della stagione delle piogge e al termine di queste fino all’arrivo della stagione invernale al nord. Al centro sud la malattia è presente durante tutto l’anno.
In particolar modo sono presenti focolai nelle grandi città dove sono presenti le grandi concentrazioni di popolazione. La dengue è una malattia virale trasmessa dalla puntura delle zanzare del genere Aedes. La malattia è molto diffusa nelle aree urbane.
La prevenzione consiste nel porre attenzione alla puntura degli insetti ed alla protezione con repellenti. Noi consigliamo NOZETA – olio di NEEM, molto efficace e con caratteristiche repellenti e lenitive.
Chikungunya:
Focolai epidemici di questa arbovirosi, simile alla dengue, si verificano in tutto il paese.
Casi di Tubercolosi si ritrovano durante i viaggi in India? (TB):
La TB è un’altra malattia importante in India, sviluppata in particolare nei villaggi e nei sobborghi della grande città. Presenta un alto tasso di mortalità. Secondo l’OMS, India ha la seconda più alta incidenza di TB in Asia.
Ci sono casi di rabbia canina o di altri animali in India?: (clicca qui)
presenti casi diffusi nel paese in particolare in animali selvaggi. Opportuno valutare i rischi per eventuale pratica vaccinale.
E’ presente la filaria, o la schistosomiasi (bilarzia) o oncocerca, la cecità dei fiumi in India?
(NTD): (clicca qui)
Le NTD sono un gruppo di malattie trascurate che colpiscono le persone che vivono in povertà e in aree rurali. In India, le NTD includono la filariosi linfatica, l’oncocercosi e la schistosomiasi.
Queste sono alcune delle principali malattie presenti in India.

Vaccinazioni
Quale vaccinazione è obbligatoria per l’India e come bisogna comportarsi?
FEBBRE GIALLA se…..
- il vaccino della FEBBRE GIALLA
– non è obbligatorio per tutti coloro che provengono da Europa, Nord America e Australia e non sono passati per Africa o America Centro Meridionale negli ultimi 6 mesi.
– è obbligatorio per ogni persona (ad eccezione dei bambini di meno di sei mesi), proveniente per via aerea o marittima; senza il certificato di vaccinazione la persona viene isolata per un massimo di 6 giorni
(i) se ha lasciato una area dove è presente il rischio di trasmissione della malattia meno di 6 giorni prima del suo arrivo, o
(ii) se è passata in transito in una di quelle zone, fatta eccezione per quei passeggeri e membri dell’equipaggio che, per tutta la durata del loro transito in un aeroporto situato in un’area dove è presente il rischio di trasmissione della malattia, soggiornino negli edifici dell’aeroporto, posto che il medico dell’aeroporto consenta questa deroga, o
(iii) se è arrivata con una nave che ha lasciato o toccato un porto situato in una area dove è presente il rischio di trasmissione della malattia meno di 30 giorni prima del suo arrivo in India, salvo che questa nave sia stata disinfestata conformemente alla procedura stabilita dall’OMS.
(iv) se è arrivata con un aereo che, essendosi trovato in un’area dove è presente il rischio di trasmissione della malattia, non sia stato disinfestato conformemente alle disposizioni del Regolamento dell’India per la Navigazione aerea (Sanità pubblica), del 1954 o alle disposizioni raccomandate dall’OMS.I paesi e zone seguenti sono considerati a rischio di trasmissione:
- –Africa: Angola, Benin, Burkina Faso, Burundi, Camerun, Ciad, Congo, Costa d’Avorio, Etiopia, Gabon, Gambia, Ghana, Guinea, Guinea Bissau, Guinea Equatoriale, Kenya, Liberia, Mali, Mauritania, Niger, Nigeria, Repubblica Centroafricana, Repubblica Democratica del Congo,Ruanda, Senegal, Sierra Leone, Sudan,Sud Sudan, Togo, Uganda.
- –America: Argentina, Bolivia, Brasile, Colombia, Ecuador, Guyana, Guyana Francese, Panama, Paraguay, Perù, Suriname, Trinità e Tobago, Venezuela. Nota: Quando un caso di febbre gialla viene segnalato in un paese diverso da quelli sopra menzionati, tale paese viene considerato dal Governo dell’India come area dove è presente il rischio di trasmissione della malattia ed è aggiunto a questa lista.
Questo paese considera il certificato di vaccinazione per la Febbre Gialla valido per la vita (emendamento 0MS 11.07.2016). Consigliamo comunque la verifica diretta prima di partire, considerando i continui cambiamenti nei regolamenti dei singoli paesi.(Aggiornamento Marzo 2023)
Quali vaccinazioni sono consigliate per l’India, e come bisogna comportarsi?
devo fare la vaccinazione per la FEBBRE GIALLA in India (clicca qui)
La vaccinazione non é richiesta ne è raccomandata ad alcun viaggiatore proveniente dall’Italia, Europa, Nord America, Australia in quanto il virus non è presente in Asia e non esiste alcun rischio di contagio.
Altre vaccinazioni consigliate:
E’ consigliata la vaccinazione per la DENGUE ?.
Vista la presenza di focolai diffusi nel paese, in aumento durante la stagione monsonica è consigliato valutare la possibilità di effettuare il nuovo vaccino per la DENGUE.
La prevenzione consiste nella attenzione alla puntura degli insetti ed alla protezione con repellenti. Noi consigliamo NOZETA – olio di NEEM, molto efficace e con caratteristiche repellenti e lenitive. Importante valutare l’inoculazione del nuovo vaccino per la Dengue, denominato QDENGA
Per informazioni e prenotazioni del vaccino della DENGUE (CLICCA QUI)
E’ consigliata la vaccinazione per EPATITE A
E’ consigliata la vaccinazione per FEBBRE TIFOIDE– per saperne di più….
SINDROMI DIARROICHE E COLERIFORMI
E’ consigliata la vaccinazione per il colera? La vaccinazione è essenziale per la protezione efficace dal “Vibrione del Colera” e da altri batteri patogeni intestinali anche aggressivi causa della “diarrea del viaggiatore”. Dovrebbe essere sempre considerata come protettivo dell’intestino. Può essere presa in considerazione a seconda del tipo di viaggio e di permanenza. La formulazione “orale” del vaccino anticolera protegge anche dalle infezioni intestinali provocate da molti agenti enterotossici. Il vaccino è quindi consigliato per i viaggi in molti paesi del mondo.
Questi sono vaccini essenziali per la protezione dalle infezioni “alimentari” ossia trasmesse da “cibi e bevande contaminate”; “mani sporche”; stoviglie, piatti, bicchieri contaminati: (valide ovunque, in Italia e nella maggior parte dei paesi del mondo)
EPATITE B per saperne di più….
Protezione da contatto con sangue infetto: in caso di medicazione per incidente durante il viaggio (in ambulatori o PS locali) per infezioni da ferri medicazione; siringhe in strutture sanitarie con scarsa igiene; trasmissione sessuale rapporti sessuali non protetti; altri contatti con sangue; (valide ovunque, in Italia e nella maggior parte dei paesi del mondo)
MENINGITE MENINGOCOCCICA per saperne di più…
Protezione da infezioni trasmesse da goccioline della saliva, respirazione e tosse, attraverso l’aria, in aeroplano, luoghi affollati, bus e treni, uffici e scuole, ambienti poco areati; (Per una sua protezione personale e per una protezione delle persone che le stanno vicino (famiglia – lavoro) – possibilità di diventare portatore sano del batterio della meningite.) (valide ovunque, in Italia e nella maggior parte dei paesi del mondo)
TETANO per saperne di più…
POLIOMIELITE
In seguito agli ultimi dati epidemiologici e relative raccomandazioni emanate dall’OMS, ai viaggiatori è raccomandato un richiamo del vaccino (IPV-iniettivo) meglio da effettuare insieme a (tetano-difterite-pertosse- vaccino quadrivalente) da richiamare ogni 10 anni. L’efficacia del vaccino, essendo un richiamo a vaccinazioni fatte nel passato è immediata.
Protezione da infezioni trasmesse da micro-particelle fecali presenti nel terreno, contatti ed ingestione; (valide ovunque, in Italia e nella maggior parte dei paesi del mondo)
VACCINAZIONI DI ROUTINE
Assicurati di aver effettuato tutte le vaccinazioni previste dal Sistema Sanitario Nazionale. Queste prevedono: tetano, difterite, polio, pertosse, haemophilus B, epatite B, morbillo, parotite, rosolia, varicella.
ENCEFALITE GIAPPONESE (per saperne di più)
L’Encefalite Giapponese è una malattia virale acuta grave trasmessa dalle zanzare, che può portare a sintomi neurologici gravi, come convulsioni e coma. In India, la malattia è più comune nelle zone rurali e durante la stagione delle piogge, dove sono presenti animali da cortile, ed in particolare i suini, serbatoio privilegiato del virus . Per ridurre il rischio di contrarre la malattia, è importante prendere precauzioni come l’uso di repellenti per insetti e di reti antizanzare trattate. E’ bene evitare le zone dove dove sono presenti le zanzare come le risaie e le zone umide, e considerare, facendo una valutazione del rischio reale, la vaccinazione contro la Encefalite Giapponese prima di viaggiare in India. Consulta il medico specialista prima di partire ed informati correttamente.
Malaria: situazione e prevenzione
C’è la malaria nel paese e cosa bisogna fare per non ammalarsi?
Che cosa é?
La Malaria è una malattia infettiva, acuta, presente nel paese, molto legata agli’ ambienti umidi, piovosi, alle stagioni ed alle condizioni meteorologiche. Controlla prima di partire l’itinerario del tuo viaggio e le condizioni meteo delle aree dei tuoi soggiorni. Ricorda che la Malaria è una malattia potenzialmente grave ed anche fatale. Non sottovalutarla. E’ possibile prevenirla con una attenzione al vestiario che ti copra le parti scoperte al tramonto e la notte, all’utilizzo di repellenti e all’ utilizzo di adeguati farmaci per la profilassi, nelle stagioni di maggior rischio. Per approfondire leggi la scheda sulla malaria
Nel paese
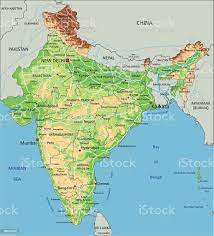
- Il rischio di malaria (P. vivax 40-50%, P. falciparum 50-60%, P. malariae and P. ovale rari) esiste tutto l’anno nell’intero Paese al di sotto dei 2000 metri, in tutto il paese, comprese le città di Bombay (Mumbai) e Delhi, tranne nelle aree> 2.000 m (6.562 piedi) in Himachal Pradesh, Jammu e Kashmir e Sikkim . Il rischio da P. falciparum è maggiore negli stati nord orientali, nelle isole Andamane e Nicobare, negli stati di Chattisgarh, Gujarat, Jharkhand, Karnataka, Madhya Pradesh, Maharasthra , Orissa, e West Bengala.
 da CDC- YELLOW BOOK 2020
da CDC- YELLOW BOOK 2020
(Aggiornato a Marzo 2023)
Profilassi
Doxiciclina, è un ottimo farmaco di scelta per i soggiorni sia in aree turistiche che in viaggi avventurosi, durante trekking e in caso di utilizzo di tende o residenze poco controllate. Farmaco per i soggiorni in residenze protette o aree di lieve rischio, sia per soggiorni a rischio elevato. Devi sapere che la “doxiciclina 100 mg” è un farmaco di scelta non solo per la prevenzione della infezione malarica ma anche per la prevenzione delle infezioni batteriche intestinali e cutanee e verso le infezioni causate da punture di zecca. Per le sue caratteristiche il farmaco è molto versatile, può essere infatti assunto per soggiorni brevissimi o brevi, alcuni giorni o settimane, ma anche nel lungo periodo, cioè per molti mesi. Ti ricordiamo che farmaci a base di tetracicline, compresa la doxiciclina, vengono assunti per oltre 1 anno da ragazzi che manifestano l’acne, cioè infezioni sul volto o tronco. Un farmaco sicuro, efficace, privo o con scarsi effetti collaterali. Ricordiamo che alle dosi di profilassi, 100 mg al giorno, gli effetti di sensibilizzazioni ai raggi solari, sono praticamente assenti. In ogni caso ricordiamo l’uso di creme solari. Farmaco di basso costo. Non è utilizzabile al di sotto dei 12 anni o in gravidanza, o in caso di allergia o intolleranza alle tetracicline. Si assume tutti i giorni, durante il pranzo, dalla entrata in area a rischio, per una settimana dalla uscita dall’area di rischio malarico.
Atovaquone-Proguanile, farmaco sul mercato da quasi 20 anni possiede ancora una buona copertura antimalarica per le forme resistenti alla clorochina, anche se sono state descritte da diversi anni forme di resistenza e di scarsa efficacia. Utile per l’utilizzo pediatrico, Utilizzato per periodi non superiori ai 30 giorni, ma utilizzabile fino a 60 giorni. Si assume una compressa tutti i giorni da 2/3 giorni prima di partire ad 1 settimana al rientro.
Meflochina, farmaco utilizzato da oltre 30 anni, Efficace in profilassi e in terapia. Efficace sia negli adulti che anche in età pediatrica. Efficacia e sicurezza dimostrata anche nelle donne in gravidanza. Utilizzabile in soggetti in buone condizioni di salute. Da non utilizzare nei cardiopatici, soggetti aritmici, neuro e psicopatici, in chi soffre di insonnia. Riferiti sintomi da irritabilità del sistema nervoso periferico e centrale. Da evitare in chi effettua immersioni, soggiorni in alta quota, voli aerei ripetuti e prolungati. Favorevole la modalità di assunzione che prevede una dose settimanale da una settimana prima di partire a 3/4 settimane al rientro.
Cosa devo fare se rientro con dei problemi di salute dal viaggio?
In caso di febbre, di diarrea o comunque di malessere, è indispensabile consultare senza indugio (in caso di febbre, possibilmente entro 24 ore, per la possibilità di aver contratto la malaria, se si è di ritorno da una zona a rischio) un Medico Specialista o esperto in Malattie Tropicali.
Tradizioni, cibi, bevande locali
Quali sono alcune curiosità e quali le tradizioni maggiori del paese?
Alcune degli argomenti da approfondire legati alle tradizioni più importanti dell’India:
L’India è un paese con una cultura ricca di tradizioni e curiosità interessanti. Ecco alcuni fatti da conoscere:
- L’India è stata la culla di quattro delle principali religioni del mondo, tra cui induismo e buddhismo. Circa l’84% della popolazione indiana è induista, ma il paese ospita anche una delle più grandi comunità musulmane al mondo.
- La cultura indiana è costruita su secoli di storia e patrimonio, rendendola una delle più antiche del mondo. Le radici della cultura indiana risalgono a secoli fa e godono di alcune delle architetture più antiche del mondo.
- L’induismo è la più grande religione dell’India, con più del 79,8% della popolazione che pratica questa fede. L’induismo è una religione complessa, molto diversa da quella occidentale e comprende diverse filosofie, credenze e rituali.
- L’India è nota per la sua arte e cultura, tra cui la danza Chhau, che è stata riconosciuta dall’UNESCO come patrimonio culturale immateriale dell’umanità nel 2010. La danza Chhau è una forma di narrazione teatrale eseguita da gruppi di soli uomini .
- Una delle tradizioni importanti dell’India è quella di pulirsi con una doccia o un bagno prima di entrare in un tempio, o almeno lavarsi mani e piedi per purificarsi da pensieri negativi e influenze negative. Inoltre, l’abbigliamento adeguato è molto importante, indossare abiti conservativi per mostrare rispetto.
Quali sono alcuni abiti tradizionali in India?
L’abbigliamento tradizionale indiano varia da regione a regione, con ogni gruppo etnico che ha il proprio stile distintivo e le proprie tecniche di tessitura e colorazione dei tessuti.
Il Sari è un abito tradizionale indiano per le donne, composto da una lunga striscia di tessuto avvolta intorno al corpo.
Il Salwar Kameez è un abito tradizionale indiano per le donne, composto da una tunica lunga (kameez) e pantaloni larghi (salwar).
Il Kurta è una tunica lunga tradizionale indiana per gli uomini, spesso indossata con pantaloni tradizionali come i churidar o i pajama.
Il Dhoti un indumento tradizionale indiano per gli uomini, composto da un pezzo di tessuto bianco avvolto intorno alla vita e alle gambe.
Il Ghagra Choli è un abito composto da una gonna lunga e una camicetta assortita indossato dalle donne nelle feste di matrimonio e altre occasioni.
Il Bandhgala è un abito formale simile a una giacca indossato dagli uomini.
Lo Sherwani è un abito tradizionale indossato dagli uomini in occasioni formali come matrimoni e feste.

Molti tessuti tradizionali indiani sono realizzati con cotone, lana o seta, tessuti naturali che riflettono l’ambiente naturale del paese. Le donne indiane, seguendo la tradizione millenaria, indossano anche bijoux tradizionali, come collane di perle, braccialetti di metallo e orecchini fatti a mano. I tessuti tradizionali sono spesso utilizzati per creare abiti per occasioni speciali come matrimoni, funerali, cerimonie religiose e altri eventi importanti. L’abbigliamento tradizionale è un modo per mantenere viva la cultura e le tradizioni dell’ India e viene spesso indossato durante le celebrazioni culturali e le feste.
Un approfondimento sulle POPOLAZIONI ed alcuni aspetti tradizionali
Ci sono molte popolazioni diverse e tribù in India, ognuna con le proprie tradizioni e culture uniche. Vi presentiamo una lista sintetica di alcuni gruppi etnici e le loro tradizioni:
Punjabi – noti per la loro cucina piccante, la danza bhangra e il turbante tradizionale chiamato pagri.
Gujarati – noti per la loro cucina vegetariana, i costumi colorati e la danza garba.
Rajasthani – noti per i loro abiti tradizionali come il ghagra choli e il turbante, la danza kalbelia e l’arte del block printing.
Bengalese – noti per la loro cucina a base di pesce, la danza rabindra nritya e la celebrazione del Durga Puja.
Marathi – noti per la loro cucina a base di riso e pesce, la danza lavani e la celebrazione di Ganesh Chaturthi.
Tamil – la cultura tamil è nota per la sua musica classica, danza Bharatanatyam e la cucina del sud dell’India.
Kashmiri – noti per la loro cucina a base di agnello,
Quali sono i 10 cibi tradizionali di maggior interesse?
Dieci dei cibi tradizionali più famosi dell’India:
Chana Masala: Un popolare piatto vegetariano fatto di ceci, salsa di pomodoro e cipolla, aglio, zenzero, peperoncini e spezie.
Chaat: Un insieme di snack indiani a base di riso soffiato, piselli, verdure e spezie.
Paratha: Un tipo di pane piatto ripieno di patate, cipolle, verdure o formaggio e servito con chutney e yogurt.
Biryani: Un piatto di riso speziato e misto con carne, pesce o verdure.
Dosa: Un pancake sottile fatto di riso e lenticchie servito con chutney.
Samosa: Un antipasto triangolare ripieno di patate, piselli, carne, spezie e fritto.
Thali: Un piatto completo che include riso, pane, verdure, dal, raita, papadum e altre specialità regionali.
Aloo Gobi: Un piatto vegetariano di cavolfiore e patate cotto con spezie.
Vada: Un antipasto fritto a forma di donut fatto di lenticchie speziate.
Idli: Un piatto a base di riso e lenticchie cotto a vapore, spesso servito con chutney.
Quali le 10 bevande della tradizione che possiamo provare ed assaggiare durante il soggiorno?
Chai: Tè indiano speziato con latte e zucchero.
Lassi: Una bevanda a base di yogurt, zucchero e frutta fresca.
Thandai: Una bevanda a base di latte e spezie, spesso servita durante le celebrazioni di Holi.
Nimbu Pani: Una bevanda a base di limone, zucchero e acqua.
Sharbat: Una bevanda rinfrescante a base di sciroppo di frutta e acqua.
Jal Jeera: Una bevanda a base di acqua, lime, coriandolo, menta e spezie.
Badam Milk: Una bevanda a base di latte e mandorle.
Kanji: Una bevanda fermentata a base di carote e spezie.
Aam Panna: Una bevanda a base di mango, menta e spezie.
Masala Soda: Una bevanda gassata a base di soda e spezie come zenzero, limone e peperoncino.
Quali sono le mete culturali e turistiche di maggior interesse del paese meta del mio viaggio?
L’India è un paese vasto e variegato, ricco di cultura e storia, con alcune delle civiltà più antiche della terra. Un buon modo per pianificare la tua vacanza è vedere cosa ha da offrire in termini di cultura e storia. Ecco le 10 mete da non perdere per chi viaggia nel sub continente Indiano:
- Taj Mahal, Agra
- Jaipur, Rajasthan
- Goa
- Kerala zone costiere
- Varanasi, Uttar Pradesh
- Bombay, Maharashtra
- Ladakh, Jammu e Kashmir
- Hampi, Karnataka
- Darjeeling, Bengala Occidentale
- Delhi, capitale dell’India

Quali le info generali che mi sono utili durante il viaggio?
Capitale: New Delhi;
Lingua: Hindi (lingua nazionale),
Assamese, Bengali, Gujarati, Kannada, Kashmiri, Konkani, Malayalam, Manipuri, Marathi, Nepali, Oriya, Punjabi, Sanscrito, Sindhi, Tamil, Telugu, Urdu (tutte ufficiali), Inglese.
Moneta: Rupia indiana
Fuso orario: GMT +5, 30
Medici e strutture sanitarie: Medici e strutture ambulatoriali membri ISTM (International Society of Travel Medicine) Chatterjee, SantanuWellesley MedicentreWellesley Mansions 44A, Rafi Ahmed Kidwai Road (off Park St.)700016-Calcutta India Tel.: [+91] (33) 4553578; Fax: [+91] (33) 2491217 Ramasubramanian, VApollo HospitalsGreams lane, Greams Road600006-ChennaiIndia Tel.: [+91] (44) 2829 3333; Fax: [+91] (44) 2372 1139 Mehra, AnilAmas Medical Services Pvt. Ltd.41, Pali Hill,Nargis Dutt Road, Bandra400 050-MumbaiIndia Tel.: [+91] (22) 2649 1537; Fax: [+91] (22) 2600 8620 AMBASCIATE – CONSOLATI USA Ambasciata: Shantipath, Chanakyapuri, New Delhi – 110021Tel: 011-2419-8000Fax: +91-11-2419-0017 American Center24, Kasturba Gandhi MargNew Delhi – 110001Tel: 011-2331-6841 Consolato Generale: 5/1, Ho Chi Minh Sarani, Kolkata- 700071Tel.: 033-3984-2400 CANADA Canadian High Commission: 7/8 Shantipath, Chanakyapuri New Delhi 110 021, India Tel.: (91-11) 2687-6500
Storia,Economia,Cultura: http://www.britannica.com https://www.cia.gov
Sicurezza: www.viaggiaresicuri.it www.dovesiamonelmondo.it
Alcune informazioni sanitarie utili per mantenere la salute in viaggio
Quali sono le regole principali e come mi devo preparare per affrontare il viaggio?
Dai tempo al tuo organismo di ambientarsi al nuovo clima ed al nuovo ambiente. Prima del viaggio, se possibile, dedica alcune ore alla attività fisica, e abitua il tuo organismo ai nuovi ritmi durante il viaggio…leggi tutto
Come mi devo proteggere dalla puntura delle zanzare e di altri insetti?
Zanzare & co. – Come proteggersi : le zanzare che trasmettono malattie diverse dalla malaria sono attive durante il giorno ed ovunque vi sia una raccolta di acqua dolce: indossare abiti di colore chiaro, lunghi e con maniche larghe, pantaloni lunghi e larghi, di colore chiaro, magliette o camicie con maniche lunghe e larghe e di colore chiaro da infilare nella cintura dei pantaloni…… leggi tutto
Ma è proprio pericoloso fare il bagno in alcuni laghi o fiumi dei paesi tropicali? E perché?
Per prevenire l’eventuale trasmissione di malattie infettive, è opportuno nuotare esclusivamente in piscine con acqua clorata. L’acqua del mare è sicura.
Fare il bagno in acque contaminate può essere pericoloso per la pelle, gli occhi, le orecchie, le mucose della bocca, specialmente se… leggi tutto
Come devo fare ad evitare il mal di montagna?
E’ un insieme di sintomi che si può manifestare quando l’organismo umano, superati i 2500 metri di altitudine, non si è ancora adeguato alla nuova situazione ambientale. Possiamo definire l’alta quota come segue… Leggi tutto
Come viaggiare in sicurezza? Chi devo avvisare prima di partire per un viaggio, soprattutto in paesi lontani, poco sicuri?
Sicurezza: www.viaggiaresicuri.it www.dovesiamonelmondo.it
In valigia
Montagna o mare, safari e avventura o vacanza di tutto riposo, caldo o freddo: devi preparare il tuo bagaglio con cura, attenzione, senza esagerare e soprattutto prevedendo ……l’imprevedibile. Abbigliamento appropriato al clima e non dimenticando mai una piccola farmacia da viaggio. …leggi tutto
Al rientro a casa
Quan do rientri da un viaggio ricorda di prenderti una pausa di un tempo sufficiente per riadattare il tuo organismo al tuo ambiente ed ai tuoi ritmi di vita. Stanchezza, malessere, senso di vuoto, scarsa capacità alla concentrazione….leggi tutto


















 da CDC- YELLOW BOOK 2020
da CDC- YELLOW BOOK 2020


 arti; interventi su lesioni ad organi interni; traumi della colonna e delle articolazioni. L’afflusso delle persone rimaste sotto le macerie e salvate in qualche modo è continuo, e l’ospedale ha necessità di funzionare 24 ore al giorno.
arti; interventi su lesioni ad organi interni; traumi della colonna e delle articolazioni. L’afflusso delle persone rimaste sotto le macerie e salvate in qualche modo è continuo, e l’ospedale ha necessità di funzionare 24 ore al giorno.

 Consulenza prima del viaggio
Consulenza prima del viaggio
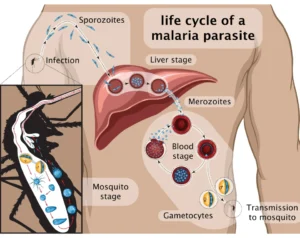

 importante presente in un individuo può rendere negativa la presenza del parassita. Una lettura di un vetrino effettuata da occhi inesperti o affrettata può dare una risposta negativa, pur essendo presente il parassita. La diagnosi clinica, derivata da una valutazione dei sintomi, non può essere cancellata da un test negativo, la cui risposta non è sempre veritiera.
importante presente in un individuo può rendere negativa la presenza del parassita. Una lettura di un vetrino effettuata da occhi inesperti o affrettata può dare una risposta negativa, pur essendo presente il parassita. La diagnosi clinica, derivata da una valutazione dei sintomi, non può essere cancellata da un test negativo, la cui risposta non è sempre veritiera.


 Il progetto “POZZI a energia solare e RETE IDRICA per ACQUA nel WAJIR-KENYA”
Il progetto “POZZI a energia solare e RETE IDRICA per ACQUA nel WAJIR-KENYA”
