INFLUENZA 25/26: la Variante K del virus influenzale A/H3N2 corre veloce.
INFLUENZA 25/26: la Variante K del virus influenzale A/H3N2 corre veloce.
In questo articolo voglio fornire una descrizione delle caratteristiche biologiche e cliniche e qualche consiglio di come proteggersi.
Il VIRUS protagonista indiscusso della stagione 2025/26 è costituito dalla variante K (sottoclade K) del virus influenzale A/H3N2, identificato come “improvvisa” variante emergente già a partire dall’agosto 2025 in Australia. E vi ricorderete che vi avevamo preannunciato che questo ceppo influenzale presentava allora, ed oggi è confermato, sette mutazioni della “proteina emoagglutinina” che gli conferiscono una straordinaria capacità di “eludere l’immunità pregressa della popolazione”, risultante da vaccinazioni precedenti o infezioni naturali passate. E questo rende il mixovirus di quest’anno particolarmente diffusivo.
È fondamentale sottolineare che questa variante K NON presenta una maggiore aggressività o severità clinica rispetto all’H3N2 stagionale tradizionale. Piuttosto, la vera caratteristica biologica della variante K risiede nella sua efficienza replicativa e nella velocità di trasmissione, che le ha permesso di prolungare significativamente la stagione influenzale negli emisferi meridionali (Australia e Nuova Zelanda) per almeno un mese oltre il normale.
Questo aspetto è clinicamente rilevante perché, sebbene la variante non sia più virulenta, la sua capacità di eludere parzialmente l’immunità della popolazione ha generato un picco epidemiologico anticipato e potenzialmente più ampio. Le sequenze genomiche depositate nel database internazionale confermano che in questo periodo invernale il subclade K è nettamente predominante anche in Italia, rappresentando la spina dorsale dell’epidemia attuale.
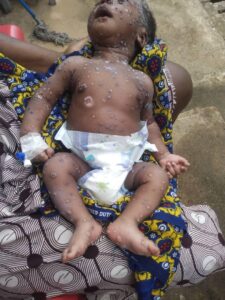
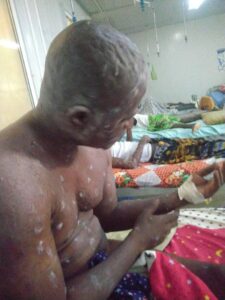
Clinicamente, l’infezione da variante K presenta il classico spettro sintomatologico dell’H3N2 stagionale:
- febbre alta (>38°C) ad esordio brusco,
- tosse intensa,
- faringite,
- dolori muscolari e articolari marcati,
- stanchezza profonda,
- congestione nasale
- nei bambini, disturbi gastrointestinali (nausea, vomito, diarrea).
È degno di nota che l’H3N2, indipendentemente dal sottoclade, produce manifestazioni febbrili più pronunciate rispetto all’H1N1, che invece tende a manifestarsi con sintomi respiratori superiori più salienti (tosse persistente, mal di gola, congestione nasale).
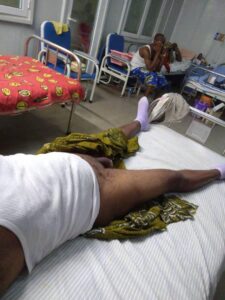
Tra le complicanze specifiche documentate figurano
- le otiti media,
- sinusiti,
- bronchiti e polmoniti,
- con un rischio aumentato in determinate popolazioni vulnerabili:
- anziani over 65,
- bambini sotto i 5 anni,
- donne in gravidanza,
- persone affette da patologie croniche respiratorie (asma, BPCO) o cardiache,
- individui immunocompromessi.
- con un rischio aumentato in determinate popolazioni vulnerabili:
Diffusione Geografica e Temporale: Il Picco Imminente
La diffusione della variante K in Italia mostra le medesime caratteristiche osservate nell’emisfero Sud:
- un picco epidemiologico anticipato (già evidente a metà dicembre 2025)
- con previsioni di raggiungimento del picco massimo tra la fine del 2025 e mese di gennaio 2026.
Gli esperti dell’Istituto Superiore di Sanità evidenziano tuttavia l’impossibilità di una previsione esatta del momento del picco, sottolineando che esso potrebbe verificarsi in qualsiasi momento tra fine dicembre e inizio febbraio.
Questa proiezione temporale è supportata dal fatto che l’A/H3N2 ha circolato molto poco negli anni precedenti nella popolazione italiana, generando una cohorte ampia di individui suscettibili, soprattutto nei bambini. Tale gap immunitario a livello di popolazione rappresenta il terreno fertile per una diffusione accelerata.
La pressione ospedaliera attesa (richiesta di ricoveri per sintomi gravi) dalle autorità sanitarie è descritta come “alta”, con particolare preoccupazione per il mantenimento della capacità di risposta nelle strutture di emergenza-urgenza durante il periodo festivo, noto per ridotte disponibilità di personale sanitario e disponibilità di letti.
Contesto Globale: La Stagione “Record” negli USA 2024/25
Per contestualizzare la gravità della stagione 2024-2025, è illuminante considerare i dati epidemiologici dagli Stati Uniti, dove la sorveglianza è particolarmente rigorosa.
Durante i mesi di picco (ottobre 2024-maggio 2025), gli USA hanno registrato oltre
- 47 milioni di casi influenzali, il dato più elevato dal 2010-2011,
- con 610.000 ospedalizzazioni cumulative (il record storico)
- e approssimativamente 130.000 decessi per influenza.
- Il tasso di ospedalizzazione ha raggiunto il 7,0%
(confrontato al 5,6% della stagione precedente e al 4,9% di due anni prima).
Particolarmente allarmante è il dato pediatrico:
- 231 decessi registrati nei bambini,
- di cui il 90% in soggetti idonei alla vaccinazione ma non vaccinati.
- Inoltre, il 35,0% dei pazienti con influenza confermata ha richiesto una visita al pronto soccorso entro 30 giorni dall’infezione,
- percentuale superiore alla media storica (24,1% nel 2012-2013).
Un chiarimento tra le forme della “influenza aviaria H5N1 Clade 2.3.4.4b”
nei confronti della influenza umana Variante K dell’H3N2
Desidero chiarire una potenziale fonte di confusione terminologica e concettuale tra i due tipi influenzali attualmente circolanti nel mondo:
Quando si discute di “variante clade 2″ nel contesto dell’epidemia influenzale attuale, occorre distinguere nettamente tra due entità biologicamente e epidemiologicamente distinte:
- Variante K dell’H3N2 stagionale: costituita da “virus influenzale umano” endemico, caratterizzata da “trasmissione efficiente umano-umano”, bassa mortalità, dominante globalmente;
- Variante Clade 2.3.4.4b dell’H5N1 costituita ad “virus dell’influenza aviaria” ad alta patogenicità (HPAI), spillover zoonotico sporadico, ossia con possibile trasmissione uccelli – mammiferi; spillover recente in bovini da latte (ossia trasmesso da uccelli a bovini), e possibile passaggio da bovini-uomo, con tasso di mortalità estimato 38-48%
La confusione sorge talvolta dal fatto che, nella nomenclatura dell’influenza aviaria, il “clade 2.3.4.4b” si riferisce effettivamente a una linea genetica specifica dell’H5N1.
Tuttavia, nell’ambito dell’epidemia stagionale attuale (dicembre 2025), la pressione virale dominante e i dati epidemiologici pertinenti derivano esclusivamente dalla variante K dell’H3N2, non dall’H5N1.
Parliamo della rara forma di H5N1 Clade 2.3.4.4b: Situazione Epidemiologica Attuale
Sebbene non rappresenti una minaccia immediata all’epidemia stagionale in corso, la situazione dell’H5N1 clade 2.3.4.4b merita una discussione dettagliata data l’importanza della sorveglianza globale e il profilo di rischio pandemico.
Epidemiologia Umana
Dal marzo 2024 al giugno 2025, gli Stati Uniti hanno registrato 70 casi umani confermati di H5N1 clade 2.3.4.4b.
Le esposizioni erano ripartite come segue:
- 41 da bovini da latte,
- 24 da polli commerciali,
- 2 da pollame da cortile,
- 3 da fonte di esposizione sconosciuta. L’ultimo caso registrato negli USA risale a maggio 2025, suggerendo una fase calante dell’incidenza umana negli Stati Uniti.
A livello mondiale, dal 2003 al maggio 2025, l’Organizzazione Mondiale della Sanità ha documentato 972 casi confermati di H5N1 con 468 decessi, per un tasso di mortalità cumulativo del 48%.
Nel 2025 (dati fino a maggio), sono stati registrati 13 casi globali con 5 decessi, corrispondente a un tasso di mortalità del 38%.
È fondamentale evidenziare che non è stata mai documentata trasmissione uomo-uomo sostenuta di H5N1 clade 2.3.4.4b. Tutti i casi umani derivano da esposizioni dirette a fonti animali (avicoltura, bovini da latte, ecc.).
Patogenesi e Adattamento Mammifero
La particolarità biologica più inquietante del clade 2.3.4.4b è la sua progressiva adattamento a ospiti mammiferi.
Fino al marzo 2024, i virus dell’influenza aviaria ad alta patogenicità non si riteneva causassero infezioni economicamente significative nei bovini.
L’identificazione del genotipo B3.13 nei bovini da latte del Texas e Kansas ha rappresentato un precedente senza storia.
Questo genotipo ricombinante, derivante da una fusione di geni dell’HPAI H5N1 europeo e dell’LPAI nord-americano, si è successivamente diffuso a 17 stati americani e a oltre 1.000 mandrie.
Nei bovini, l’infezione si manifesta prevalentemente come mastite e ridotta produzione lattea, con sintomi respiratori lievi. Tuttavia, un genotipo distinto (D1.1), un altro ricombinante HPAI-LPAI, ha causato due casi umani gravi, uno fatale in California.
La caratteristica biologica di massima preoccupazione risiede nel dual receptor-binding capacity osservato nei ceppi bovini isolati: il virus mantiene l’avidità per i recettori α2,3-sialici (di tipo aviario) mentre acquisisce capacità di legame ai recettori α2,6-sialici (di tipo umano), presenti nell’epitelio respiratorio superiore umano. Questa adattabilità recettoriale rappresenta un passo potenziale verso una facilitazione di trasmissione inter-specie e intra-specie nell’ospite umano.
Patogenicità in Modelli Sperimentali
Studi di infezione sperimentale in furetti con il ceppo umano del Cile H5N1 (genoma D1.1) hanno documentato febbre, secrezione nasale, diarrea, secrezione oculare, letargia marcata e segni di malattia severa quali dispnea e respirazione affannosa.
Questo profilo clinico, sebbene limitato ai modelli animali, riflette il potenziale per manifestazioni respiratorie severe nell’ospite umano.
Valutazione del Rischio Pandemico
Il consenso scientifico internazionale considera l’H5N1 clade 2.3.4.4b come una “seria minaccia pandemica”. I fattori di preoccupazione includono:
- Diffusione globale continuativa nel compartimento aviare selvatico e domestico
- Incursioni in ospiti mammiferi (visoni, foche, leoni marini, bovini)
- Plasticità genetica: diversità genotipica elevata e potenziale per reassortimento con virus influenzali umani stagionali
- Spillover sporadico persistente in umani con casi umani in Cile, Canada e USA caratterizzati da gravità aumentata
Tuttavia, l’assenza di trasmissione umano-umano sostenuta e il fenomeno di “viral inert” (il virus non ha acquisito la capacità replicativa ottimale nell’ospite umano) mitigano il rischio a breve termine.
Manifestazioni Cliniche Dettagliate dell’Influenza Stagionale 2025
La variante K produce un quadro clinico indistinguibile dalla classica influenza H3N2 stagionale. I tre criteri diagnostici cardine (indicatori di sospetto diagnostico nel setting primario) sono:
- Esordio acuto di febbre sopra 38°C (in adulti) o >39°C (nei bambini piccoli)
- Almeno un sintomo respiratorio: tosse, congestione nasale, faringite
- Almeno un sintomo sistemico: mialgia marcata, artralgia, astenia profonda
L’assenza di uno di questi tre elementi depone generalmente per diagnosi alternativa (raffreddore comune da rhinovirus, per esempio).
La progressione temporale classica prevede:
- un picco sintomatologico nei giorni 2-4 di malattia, con la febbre che tende a persistere per 3-5 giorni anche in assenza di complicanze batteriche secondarie.
- La tosse e l’astenia possono protrarsi per 1-2 settimane, rappresentando frequente motivo di visita medica tardiva e preoccupazione del paziente.Differenze Sintomatologiche H3N2 vs H1N1
Studi comparativi dei dati clinici di cure primarie hanno documentato che:
– i pazienti infetti da H3N2 presentano febbre più elevata e più prolungata rispetto a quelli con H1N1;
– i pazienti con H1N1 al contrario manifestano tosse più frequente (63,8% vs 40,7%), mialgia più comune (71,8% vs 48,2%) e faringite (40,4% vs 19,0%).
Queste differenze sintomatologiche dovrebbero caratterizzare la valutazione clinica e l’approccio terapeutico.
Interazioni Virali tra diversi virus delle alte vie respiratorie.
Meccanismi Fondamentali di Interferenza Virale
La circolazione simultanea di molteplici patogeni respiratori (influenza, RSV, rhinovirus, coronavirus generici, SARS-CoV-2) non produce semplicemente una sovrapposizione lineare di malattia, ma queste interazioni virali talvolta antagoniste talvolta sinergiche determinano dinamiche patologiche complesse governate dal fenomeno “dell’interferenza virale”.
Questa si verifica quando l’infezione da un virus primario innesca una “risposta immunologica innata” (produzione interna di interferone di tipo I e III) che sopprime la replicazione di un virus secondario (fenomeno denominato challenge).
Per chiarire il fenomeno: in studi realizzati su coltura cellulare di epitelio respiratorio,
– l’infezione da virus influenzale A (IAV) o da virus respiratorio sinciziale (RSV) riduce significativamente la replicazione di SARS-CoV-2 tramite l’induzione di uno stato “antivirale” cellulare.
L’effetto è più pronunciato con IAV che con RSV.
Implicazioni Epidemiologiche e rapporto tra casi influenzali e casi di COVID: una spiegazione dell’andamento delle due epidemie:
Durante la stagione 2024-2025, questi meccanismi di competizione hanno generato un’epidemiologia caratteristica:
– una ondata massiccia di influenza (82 milioni di casi USA da ottobre 2024 a maggio 2025) ha interferito con la diffusione di SARS-CoV-2, mantenendola fortemente.
– Al diminuire dell’attività influenzale in primavera 2025, è seguita una risalita marcata di SARS-CoV-2, in particolare della variante NB.1.8.1 (derivata da JN.1), che ha causato un aumento di ospedalizzazioni.
COVID-19 e la Variante NB.1.8.1 attualmente in Circolazione
La variante di SARS – CoV-2 denominata NB.1.8.1 rappresenta un’evoluzione della linea Omicron con mutazioni aggiuntive sulla proteina spike (T22N, F59S, G184S, A435S, V445H, T478I) che conferiscono ridotta sensibilità agli anticorpi neutralizzanti. Tuttavia, i dati epidemiologici attuali indicano che NB.1.8.1 NON causa malattia più severa rispetto alle varianti Omicron precedenti. La trasmissibilità è elevata, ma la clinica prevede sintomi prevalentemente lievi, soprattutto in individui vaccinati o con infezione pregressa.
Coinfesione Influenza-COVID-19: Implicazioni Cliniche
Diversi studi hanno valutato l’impatto della coinfesione influenza-SARS-CoV-2 sulla gravità della malattia COVID-19.
Gli autori documentano che la coinfesione con influenza è associata a un aumento 2-fold del rischio di ammissione in ICU (odds ratio = 2,09, IC 95% = 1,64-2,68) e a un aumento 2,31 volte del rischio di ventilazione meccanica (IC 95% = 1,10-4,85) rispetto a infezione COVID-19 in monoterapia. Quindi un aggravamento rispetto alle singole infezioni.
Co-Circolazione di Altri Virus Respiratori
I dati RespiVirNet italiano, pubblicati da Istituto superiore di Sanità per dicembre 2025 documentano la circolazione simultanea di:
- RSV: pico raggiunto in gennaio 2025 (396 casi nella settimana 4)
- Rhinovirus: circolazione anno-round con picchi invernali, ruolo potenziale di “protezione” tramite interferenza virale verso IAV e SARS-CoV-2
- Coronavirus generici (escludendo SARS-CoV-2): 1003 casi totali stagione
- SARS-CoV-2: circolazione continua, prevalentemente variante NB.1.8.1
Efficacia Vaccinale e Protezione nella Stagione 2025
I dati scientifici ci portano ad affermare che i vaccini in uso continuano a proteggere dall’ospedalizzazione e da sintomi particolarmente gravi. E’ da sottolineare che l’efficacia vaccinale verso infezione ossia la fase di attacco acuto è ridotta, ma la protezione verso la severità (morte, ospedalizzazione) rimane solida, probabilmente per il mantenimento di epitopi B e T cellulari cross-conservati.
I pediatri dell’Istituto Superiore di Sanità sottolineano l’importanza della vaccinazione immediata, poiché i bambini, in quanto principali diffusori del virus, potrebbero raggiungere una protezione adeguata prima del picco epidemiologico previsto tra fine dicembre e inizio gennaio.
La situazione epidemiologica al 24 dicembre 2025 è caratterizzata da una massiccia ondata di influenza stagionale dominata dalla variante K dell’A/H3N2, non da una emergenza H5N1 pandemica. La variante K non è clinicamente più severa dell’H3N2 tradizionale, ma la sua capacità di eludere parzialmente l’immunità pregressa ha generato un picco epidemiologico anticipato e potenzialmente ampio. I dati italiani e globali indicano tassi di ospedalizzazione superiori alla media storica e pressione straordinaria sui sistemi sanitari.
L’H5N1 clade 2.3.4.4b rimane una minaccia di sorveglianza a lungo termine, particolarmente dati i fenomeni recenti di adattamento mammifero e la persistente spillover zoonotico, ma non rappresenta un problema epidemiologico acuto nell’ambito della stagione influenzale in corso.
La coinfezione con SARS-CoV-2 variante NB.1.8.1 e altri patogeni respiratori è possibile e comporta conseguenze cliniche misurabili (aumento di ICU e ventilazione), richiedendo vigilanza diagnostica e terapeutica avanzata nei pazienti critici.
La vaccinazione rimane la strategia preventiva primaria, con efficacia mantenuta verso la severità dei sintomi.
L’utilizzo di antivirali (oseltamivir) per pazienti ad alto rischio o con malattia conclamata rimane valido e da favorire in particolare nei portatori di patologie croniche.
redattore dr. Paolo Meo
Direttore POLO VIAGGI
INFLUENZA 25/26: la Variante K del virus influenzale A/H3N2 corre veloce. Leggi tutto »




 plopia)
plopia) 



 –
–