Lariam, una vecchia arma per la prevenzione e la cura della malaria
Lariam: un farmaco sempre meno efficace per la resistenza del Plasmodio della malaria. Presso la “Clinica del Viaggiatore Cesmet”: consulenze di prevenzione e profilassi; assistenza durante il viaggio con l’assicurazioneTHCARD; al rientro esami di laboratorio specialistici e visite tropicali. Chiama 0639030481 o scrivi ad [email protected]
ll LARIAM (MEFLOCHINA) è un medicinale antimalarico da 40 anni sulla scena della prevenzione e della cura della malaria. E’ stato utile ed efficace fin dai primi tempi per la terapia verso le forme anche gravi di malaria da Pl. Falciparum, e per la profilassi della malaria, negli anni in cui la resistenza dei plasmodi alla clorochina aumentava in modo esponenziale. Prima controindicato nelle donne in gravidanza, dagli anni ’90 è diventato il farmaco da utilizzare in corso di gestazione. Poi, anno dopo anno è iniziata una inarrestabile crescita della resistenza dei plasmodi anche a questo farmaco. Allontanato prima dall’utilizzo in terapia, è stato via via sostituito per la prevenzione dal malarone (atovaquone) e dalla doxiciclina. Attualmente si preferisce evitarne la somministrazione, non solo per gli effetti collaterali alla somministrazione ma soprattutto per la sua provata inefficacia.
Più volte segnalato per i suoi effetti collaterali sul sistema nervoso, fortemente irritativo e talvolta neurotossico, è da sempre controindicato nei soggetti cardiopatici e soprattutto nei soggetti aritmici. Va evitata la somministrazione nei soggetti ansiosi e con problematiche neuropsichiatriche, in chi deve effettuare immersioni o salire in altezza, per possibili crisi vertiginose.
Il suo punto di forza è sempre stato la somministrazione di una compressa una volta a settimana Un’altra caratteristica positiva il suo utilizzo in gravidanza.
Storia e Sintesi e Caratteristiche del Lariam
Meflochina è la denominazione del principio attivo che lo costituisce. Si tratta di 4-aminochinolina chimicamente analoga alla clorochina. La clorochina è il famosissimo prodotto di sintesi della Bayer, risalente a prima della guerra mondiale. La clorochina è stata utilizzata con successo sia nella nella cura che nella profilassi della malaria da Pl. Falciparum fino alla metà degli anni ’80. Chi scrive ricorda bene quanto fosse ancora efficace nella terapia anche di forme gravi di malaria all’inizio del proprio percorso professionale alla fine degli anni ’70, e come era diffusa nella maggior parte dei paesi africani l’utilizzo di un farmaco ancora efficace e a basso costo.
Dalla metà degli anni ’80 la clorochina perse d’efficacia e fu sostituita dal farmaco a base di Meflochina. Quest’ultima sostanza è stata sintetizzata presso il Walter Reed Army Institute of Research (WRAIR) nel 1970 poco dopo la fine della guerra del Vietnam. Data la preoccupante resistenza dimostrata alla fine degli anni ’60, in Estremo Oriente venne avvertita la necessità di trovare nuovi farmaci che fossero più efficaci e prontamente utilizzabili nella profilassi e nella terapia della malaria. In particolare la resistenza al farmaco si sviluppò in Vietnam, Cambogia e Laos, per l’utilizzo del farmaco su larga scala da parte delle truppe americane. Pertanto presso l’Istituto di Ricerca Militare Americano venne effettuata una vasta indagine indirizzata all’individuazione del nuovo farmaco.
Alla Meflochina fu assegnato il numero 142.490 su un totale di 250.000 antimalarici presi in considerazione nel corso dello studio e che al termine risultò il prescelto. Venne commercializzata sia per la profilassi, che per la terapia della malaria da Pl. Falciparum, comunemente la più grave. È da tener conto che negli studi iniziali, considerati scientificamente attendibili, ci furono delle lacune ed approssimazioni per quanto riguarda la raccolta di dati degli effetti collaterali e/o tossici del farmaco. Il primo studio randomizzato e controllato su una popolazione mista è stato infatti effettuato la prima volta nel 2001. In questo studio circa il 67% dei soggetti trattati riferì almeno un evento avverso, con il 6% degli utenti che dovettero segnalare eventi gravi con esplicita necessità di intervento medico. Alcuni trials nel 1990 e primi anni 2000 ebbero modo di verificare una certa prevalenza della neurotossicità della meflochina e significative potenzialità di effetti collaterali neuropsichiatrici.
Metabolismo e Nozioni farmacologiche
La meflochina da un punto di vista chimico è una “4-aminochinolina”. L’assunzione in coincidenza dei pasti ne aumenta la velocità e l’entità dell’assorbimento e di conseguenza la biodisponibilità, anche fino al 40%. Meflochina è metabolizzata principalmente attraverso il fegato. La sua eliminazione in un paziente epatopatico, cioè con una funzione epatica compromessa può essere prolungata, causando livelli plasmatici più elevati e un aumento del rischio di reazioni avverse. L’emivita media della meflochina nel plasma è piuttosto lunga ed è compresa tra due e quattro settimane. La clearance totale avviene attraverso il fegato, e il mezzo principale di escrezione è rappresentato dalla bile e dalle feci, mentre solamente una quantità compresa tra il 4% e il 9% viene escreto attraverso le urine. L’uso a lungo termine non ne varia l’emivita plasmatica. Comunque per verificare tempestivamente l’insorgere di un’eventuale tossicità epatica è necessario praticare test di funzione epatica con regolarità mensile durante la somministrazione a lungo termine di meflochina. L’uso di bevande alcoliche deve essere evitato durante il trattamento con meflochina.
Farmacocinetica
Meflochina è una molecola chirale, cioè speculare, con due centri di carbonio asimmetrici, il che significa che ha quattro stereoisomeri differenti. Il farmaco è attualmente prodotto e venduto come “racemato degli enantiomeri (R, S)- ed (S, R)-“ da Hoffman-LaRoche. In sostanza, si tratta di due farmaci in uno. Esiste come miscela racemica di quattro isomeri ottici con potenza antimalarica analoga. La meflochina differisce dagli alcaloidi della cincona per la diversa sostituzione sull’anello chinolinico, per la presenza di un anello piperidinico al posto di quello chinuclidinico e per l’assenza del gruppo vinile. Le concentrazioni plasmatiche dell’ (-)-enantiomero sono significativamente più elevate rispetto a quelle dell’ (+)-enantiomero, e anche la farmacocinetica dei due enantiomeri è significativamente differente. L'(+)-enantiomero ha un’emivita più breve dell’ (-)-enantiomero.
Secondo alcune ricerche, l’(+)-enantiomero è più efficace nel trattamento della malaria, mentre l'(-)-enantiomero si lega specificamente ai recettori dell’adenosina nel sistema nervoso centrale, il che può spiegare alcuni dei suoi effetti psicotropi. Non è noto se per la meflochina si può verificare uno switching stereoisomerico in vivo. Altri studiosi ricorrono, per spiegare il meccanismo neurotossico della meflochina, ad un blocco dei meccanismi di efflusso del calcio dalle cellule, che determinerebbe un esaurimento neuronale. Meccanismo d’azione della meflochina Il meccanismo d’azione, anche se non del tutto chiarito, sembra risiedere nell’induzione del rigonfiamento dei lisosomi del parassita, che non sembra in grado di intercalare il DNA . Anche se non inibisce l’eme-polimerasi, lega l’eme, formando dei composti tossici in grado di alterare le membrane dei parassiti e di interagire con altri componenti del plasmodio. È uno “schizonticida ematico” contro P.falciparum e P.vivax. Non è attivo sui gametocidi di P.falciparum e sulla fase epatica di P.vivax.
Uso in terapia e profilassi
Il Lariam-meflochina è venduto sotto forma di compresse da 250 mg. Si può assumere sia per la profilassi che per il trattamento della malaria. In funzione profilattica la dose da assumere è di una compressa da 250 mg a settimana, in coincidenza di un pasto principale, a partire da una o due settimane prima della partenza verso una zona malarica, per tutta la durata del soggiorno naturalmente e fino a quattro settimane dall’uscita dall’area a rischio malarico, in modo da coprire tutto il periodo di incubazione della malaria. L’inizio della profilassi con largo anticipo serve a controllare l’insorgenza di eventuali effetti collaterali, causati dalla meflochina stessa. A tale proposito si deve rammentare la possibilità dell’interferenza della contemporanea assunzione di meflochina con la vaccinazione orale anti tifoidea che può essere inattivata e risultare non efficace. Per cui il consiglio è di vaccinarsi con debito anticipo prima dell’inizio della profilassi con meflochina.
Nel caso si debba utilizzare per il trattamento di una malaria appena diagnosticata, la dose è di tre compresse il primo giorno, due dopo sei-otto ore, e una infine dopo il medesimo intervallo, se il peso del paziente è superiore a 60 Kg. La dose terapeutica totale è di 20-25 mg/kg raccomandata in caso di viaggio in zona endemica. Una dose più bassa, equivalente a 15 mg/kg, può essere sufficiente in individui parzialmente immuni, cioè persone cresciute in zona malarica e che quindi hanno sviluppato a contatto con il parassita una sorta di protezione, però labile, nei suoi confronti. Quindi la dose totale di meflochina per gli adulti e per i bambini occidentalizzati, che si accingono a fare un viaggio in zona malarica, di peso superiore a 45 kg, è di 1250-1500 mg (es. 5-6 compresse in tutto di Lariam).
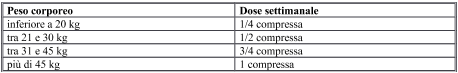
Peso corporeo Pazienti viaggiatori
Inferiore a 20 Kg 1/4 compressa /2,5-3 Kg
Tra 20 e 30 Kg 2-3 compresse
Tra 31 e 45 Kg 3-4 compresse
Tra 46 e 60 Kg 5 compresse
Oltre 60 Kg 6 compresse
Effetti collaterali
Un effetto collaterale molto frequente della somministrazione della meflochina e che può anche rappresentare un sintomo della malaria è il vomito. Se si manifesta a distanza di meno di mezz’ora dall’assunzione del farmaco per via orale è necessario ridare l’intera dose. Se questo avviene a distanza di 30-60 minuti allora se ne somministra metà dose. Non è sempre garantita l’efficacia, come è noto quando si parla di profilassi, per cui se la terapia con meflochina non risulta efficace in un dato paziente e la sintomatologia della malaria perdura, si deve ricorrere al trattamento con altri farmaci antimalarici. Il chinino o l’alofantrina, potrebbero risultare scarsamente attivi, non solo nel caso che la meflochina sia stata precedentemente adoperata come terapia, ma anche se lo è stata a scopo profilattico. E si potrebbero verificare effetti tossici. Una scelta ottimale può risultare la terapia di associazione con doxiciciclina e/o artemisina o derivati, con l’aggiunta o meno di piperachina.
Insieme al vomito sono molto frequenti, costituendo i sintomi di maggiore probabilità, i disturbi a carico della sfera digestiva, con nausea, vomito, intolleranza gastrica, che spesso si aggiungono alle vertigini. Tali disturbi, se presenti e lo sono generalmente in un numero rilevante di casi, risultano particolarmente fastidiosi in situazione di viaggio in località esotiche, in quanto aggiungono il disagio della infermità, sia pure momentanea, a quello legato agli spostamenti, magari per via aerea, con la tendenza a facilitare le sindromi a tipo cinetosi e vertiginose in genere, in una poco tollerabile sovrapposizione di sintomi.
Effetti tossici
L’uso in gravidanza non viene più sconsigliato. Studi attendibili hanno indicato la mancanza di effetti teratogenici del prodotto.
L’uso della meflochina è stato associato a due grandi categorie di disturbi neurologici:
1. disturbi del sistema nervoso centrale e periferico fra cui mal di testa, capogiri, vertigini e convulsioni
2. eventi psichiatrici tra cui insonnia, ansia, disturbi della sfera affettiva e dissociazione mentale di grado molto rilevante.
È ben noto che le interruzioni prolungate nell’efflusso di calcio dai neuroni può determinare compromissione della funzione neuronale e morte cellulare. La riduzione nella funzione o la perdita di neuroni in regioni specifiche del cervello potrebbero manifestarsi con dei sintomi specifici in pazienti trattati con meflochina. Per esempio, la vertigine riportata da molti pazienti, e che forse è uno dei sintomi maggiormente riportati, potrebbe essere attribuibile alla sofferenza neuronale nel cervelletto inferiore, mentre i sintomi di paura/ansia potrebbero sorgere in conseguenza della sofferenza di neuroni nell’amigdala. La neurotossicità da meflochina indotta nel sistema limbico potrebbe essere responsabile per i disturbi segnalati nell’emozione. Comunque i disturbi riportati con maggiore frequenza sono quelli del sonno con insonnia ed alterazione dei sogni, ad esempio incubi. Meno frequentemente sono riportati stato di agitazione, di irrequietezza, di ansia, per converso stati di depressione ed alterazione in vario senso dell’umore, con attacchi di panico, con stato confusionale, con sindromi allucinatorie e stati di aggressività, fino ad arrivare in rari casi a vere e proprie psicosi a sfondo paranoide. Ci sono stati altrettanto rari casi di tentativi di suicidio, ma non è certa la correlazione con il farmaco in oggetto.
La meflochina come altre 4-aminochinoline è suscettibile di produrre un allungamento del Q-T, a causa dell’azione sui canali del potassio a livello del muscolo cardiaco. Per cui grande attenzione va rivolta all’uso in pazienti con precedenti di cardiopatie e/o di aritmie o sotto farmaci antiaritmici. Tali effetti cardiologici tendono poi ad accumularsi in stretta adiacenza dell’avvenuta assunzione di altri farmaci antimalarici, come l’alofantrina e/o il chinino. È consigliabile monitorare la funzione elettrica del cuore con ECG in corso di trattamento con tali farmaci.
Conclusioni
La meflochina, sia per gli effetti collaterali frequenti e talvolta importanti, ma soprattutto per l’elevata e diffusa resistenza del parassita al farmaco è da considerare farmaco non più efficace e poco sicuro. Se si realizzasse infatti l’estrazione della forma (+)- enantiomerica che come abbiamo visto è più efficace e non tossica, trovato un sistema di superare il problema della resistenza, potremo avere un’arma in più a disposizione contro una malattia potenzialmente letale. Sono stati pubblicati dei lavori che illustrano la possibilità di produrre un farmaco purificato in questo modo, da parte del WRAIR. Inoltre nel giugno 2010 è stata segnalato un lusinghiero successo nel trattamento con meflochina della leuco encefalopatia multifocale progressiva, una malattia anche questa potenzialmente letale, causata da un virus, il JCV, che si associa a stati di immunodepressione grave, ad esempio l’AIDS, ma anche malattie ematiche e trattamenti con farmaci antiblastici.
Lariam, una vecchia arma per la prevenzione e la cura della malaria Leggi tutto »