Filariosi

- Descrizione
- Agente infettivo
- Ciclo vitale
- Distribuzione
- Porta di ingresso
- Trasmissione
- Incubazione
- Sintomi
- Controllo e prevenzione
- Trattamento
- Diagnosi
(da thailabonline.com/parasit.htm)
Descrizione:
Le infestazioni da Filaria sono provocate da vermi filiformi adulti ‘Nematodi’ (vermi ad anello) che si posizionano nei vasi linfatici e nei tessuti sottocutanei e possono dare luogo, a seconda dei differenti agenti patogeni a Filariasi Linfatica, Oncocercosi, Loiasi, Dirofilariasi (comune filaria parassita dei cani). Le femmine adulte fecondate producono ‘microfilarie’ che circolano nel sangue o migrano nei tessuti. Quando vengono ingerite da un insetto (zanzare o mosche), le microfilarie, all’interno dell’intestino dell’insetto vettore, si sviluppano in ‘larve infettive’ che vengono inoculate e deposte nel sottocutaneo durante la puntura. Solo poche specie di parassiti infettano la razza umana. Le filarie che parassitano gli animali, a volte infettano l’ospite umano, pur non arrivando a un completo sviluppo. Le Filariasi linfatiche sono provocate da 3 specie di Filarioidea, che può provocare una adenolinfangite acuta oppure un linfedema cronico, raramente idrocele, più frequentemente chiluria.
Agente infettivo:
Ci sono otto specie di Filaria che possono infettare l’uomo. Queste sono causa della maggior parte delle infezioni da Filarie: Wuchereria bancrofti e Brugia malayi provocano la filariasi linfatica; Onchocerca volvulus provoca la oncocerchiasi (cecità fluviale). Le altre specie sono la Loa loa, Mansonella perstans, M. streptocerca, M. ozzardi, e Brugia timori (le ultime specie possono provocare la filariasi linfatica).
Ciclo vitale:
Le larve infettive sono trasmesse da artropodi mediante il morso o puntura durante il loro pasto ematico. Le larve, inoculate nel sottocutaneo, migrano nel sito appropriato dell’ospite dove si sviluppano in ‘microfilarie’ che maturando si trasformano nelle forme adulte. Queste ultime forme possono sopravvivere nei tessuti degli ospiti anche per diversi anni. L’agente delle Filariasi linfatiche risiedono nei vasi linfatici e nei linfonodi; l’Onchocerca volvulus va a situarsi nei noduli presenti nel tessuto sottocutaneo; la Loa loa nel tessuto sottocutaneo dove migra attivamente; il Brugia malayi si situa nel tessuto linfatico, come il Wuchereria bancrofti; il Mansonella streptocerca nel derma e nel tessuto sottocutaneo; Mansonella ozzardi sembra si posizioni nel tessuto sottocutaneo e il M. perstans nelle cavità del corpo e nei tessuti circostanti. I vermi femmina, circolano nel torrente circolatorio, quelli di Onchocerca volvulus e Mansonella streptocerca, si trovano nella cute, o bulbo oculare. Le infezioni da microfilarie vengono trasmesse dal morso di artropodi (zanzare per l’agente della filariasi linfatica, mosche [Simulium] per l’Onchocerca volvulus; moscerini per Mansonella perstans e M. streptocerca; sia mosche che moscerini per Mansonella ozzardi; mosca [Chrysops] per Loa loa). All’interno dell’artropode, le microfilarie si trasformano nella forma infettiva e filariforme della larva in 1 o 2 settimane. A seguito di un successivo pasto dell’insetto, la larva infetta l’ospite. A questo punto le larve sono in grado di migrare al sito specifico di infestazione dove sviluppano la forma adulta, un processo lento che richiede anche più di 18 mesi nel caso dell’Onchocerca.
Distribuzione:
tra gli agenti della filariasi linfatica, Wuchereria bancrofti è ubiquitaria, e si trova in tutte le aree tropicali, Brugia malayi è limitata al continente asiatico e la presenza del Brugia timori è ristretta ad alcune isole indonesiane. L’agente della cecità fluviale, l’Onchocerca volvulus, si trova prevalentemente in Africa, e meno in america latina e in Medio Oriente. Fra le altre specie, Loa Loa e Mansonella streptocerca si trovano in Africa; Mansonella perstans sia in Africa che in Sud America e Mansonella ozzardi si trova solo nel continente americano.
Porta d’ingresso:
cute, tramite la puntura di artropodi.

Trasmissione:
per iniezione di microfilarie dall’artropode all’ospite durante il pasto dell’insetto.
Incubazione:
anche più di 18 mesi perché le larve sviluppino nella forma adulta nell’ospite
Sintomi:
La filariasi linfatica: produce spesso microfilaremia senza manifestazioni cliniche. Tuttavia la filariasi infiammatoria acuta comporta episodi (spesso ricorrenti) di febbre che durano da 4 a 7 giorni, linfoadenite acuta con tipica linfangite retrograda (LAA). Talvolta nel maschio funiculite acuta ed epididimite. Il linfedema transitorio di una gamba colpita può dare luogo ad un ascesso che drena all’esterno e lascia una cicatrice. La LAA in aree che drenano i linfatici delle gambe è spesso causata o aggravata da infezioni batteriche secondarie.
La filariasi cronica spesso si sviluppa insidiosamente dopo molti anni. Nella maggior parte dei pazienti si verifica una dilatazione linfatica asintomatica, ma la risposta infiammatoria cronica ai vermi adulti può portare al linfedema cronico dell’area del corpo interessata o all’idrocele. Questa situazione sintomatica grave esita in ‘elefantiasi’. Talvolta la cute si presenta ipercheratosica e con suscettibilità locale alle infezioni batteriche e micotiche. Altre manifestazioni croniche da filarie si riferiscono alla distruzione di vasi linfatici o dal drenaggio aberrante di linfa che porta a chiluria e chilocele.
L‘eosinofilia polmonare tropicale (EPT) non è comune. Essa si manifesta con frequenti attacchi di asma, transitorie opacità polmonari, febbricola e marcata leucocitosi ed eosinofilia. Le microfilarie di solito non rimangono nel sangue, ma sono presenti in ascessi eosinofili nei polmoni o nei linfonodi. La EPT è molto probabilmente dovuta a reazioni allergiche verso le microfilarie. La EPT cronica può portare alla fibrosi polmonare. Altri segni extralinfatici includono ematuria microscopica cronica, proteinuria e moderata poliartrite, causate dalla deposizione di immunocomplessi.
Episodi di LAA di solito precedono l’esordio della malattia cronica di 2 decenni. La filariasi acuta è più grave e la progressione verso la malattia cronica è più rapida negli immigranti in aree endemiche precedentemente non esposti rispetto ai residenti nativi. La microfilaremia e i sintomi scompaiono gradualmente dopo aver lasciato l’area endemica
Oncocerchiasi: i noduli sottocutanei (o più profondi) (oncocercomi) che contengono i vermi adulti sono visibili o palpabili ma per il resto asintomatici. Essi sono composti di cellule infiammatorie e tessuto fibrotico in varie proporzioni; i vecchi noduli possono necrotizzare e calcificare. La dermatite da oncocerche è causata dalle microfilare del parassita. Il prurito intenso può essere il solo sintomo in persone con infestazione lieve. Le lesioni cutanee di solito consistono in rash maculopapuloso con escoriazioni secondarie, ulcerazioni desquamanti, lichenificazione e linfoadenopatia da lieve a moderata. Possono verificarsi prematura rugosità, atrofia cutanea, massiccia tumefazione dei linfonodi inguinali o femorali, ostruzione linfatica, ipopigmentazione a chiazze e aree transitoriamente localizzate di edema ed eritema.
La dermatite da oncocerca è generalizzata nella maggior parte dei pazienti, ma nello Yemen e in Arabia Saudita è comune una forma localizzata e delineata di dermatite eczematosa con ipercheratosi, desquamazione e depigmentazione (Sowdah).
La malattia oculare varia da una moderata riduzione del visus ad una completa cecità. Le lesioni dell’occhio anteriore includono una cheratite puntata (a fiocco di neve), un infiltrato infiammatorio acuto che circonda le microfilarie morte e si può risolvere senza causare danno permanente; una cheratite sclerosante, un groviglio di tessuto fibrovascolare che può causare lussazione del cristallino e cecità; uveite anteriore o iridociclite che può deformare la pupilla. Possono verificarsi inoltre corionretinite, neurite ottica e atrofia ottica.
L’oncocercosi è la seconda causa di cecità al mondo (dopo il tracoma). La cecità è comune nella savana dell’Africa, dove è principalmente dovuta alla cheratite sclerosante; è meno comune nelle aree delle foreste pluviali, dove è causata da lesioni corioretiniche ed è di gran lunga più rara in America, dove è causata principalmente da lesioni del segmento posteriore dell’occhio.
Loiasi: l’infezione nelle persone indigene provoca nella maggior parte dei casi aree di angioedema (edema di Calabar) che può svilupparsi in ogni parte del corpo, ma prevalentemente sulle estremità; generalmente esse persistono per 1-3 giorni e sono presumibilmente correlate a reazioni di ipersensibilità agli allergeni rilasciati dai vermi adulti durante la migrazione. I vermi migrano anche nella zona sottocongiuntivale attraverso gli occhi, e ciò può creare disturbi, anche se lesioni oculari residue non sono di frequente riscontro. Alterazioni patologiche meno comuni sono costituite: dalla nefropatia, dall’encefalopatia e dalla cardiomiopatia.
La nefropatia generalmente è caratterizzata da proteinuria accompagnata da lieve ematuria e si ritiene che il danno sia causato da immunocomplessi. La proteinuria è transitoriamente esacerbata dal trattamento con dietilcarbamazina (DEC). L’encefalopatia si presenta in forma lieve ed è generalmente associata a sfumati sintomi neurologici. La DEC aggrava i sintomi neurologici fino a provocare, raramente stato di coma e decesso.
Nei viaggiatori, a differenza della popolazione locale, sono predominanti i sintomi da iper-reattività allergica. L’edema di Calabar tende a essere più frequente e più grave nei viaggiatori, che possono anche sviluppare una sindrome sistemica con ipereosinofilia che può condurre a fibrosi endomiocardica.
La diagnosi consiste nel riscontro alla microscopia ottica di microfilarie nel sangue periferico. I campioni di sangue devono essere prelevati intorno a mezzogiorno, quando i livelli di microfilaremia sono più alti. Le persone che risiedono temporaneamente in aree endemiche rimangono spesso amicrofilaremiche. I test sierodiagnostici non sono ancora in grado di differenziare la Loa loa da altre filarie.
Controllo e prevenzione:
– Filariasi linfatica: La protezione richiede la riduzione dei contatti con zanzare infette. L’efficacia della chemioprofilassi con dietilcarbamazina (DEC) non è provata. – Oncocerchiasi: L’Ivermectina si è mostrata un farmaco efficace ed in grado controllare la malattia sul territorio e di diminuire la sua prevalenza in molte zone africane. La somministrazione annuale od ogni sei mesi di ivermectina controlla efficacemente la malattia e può diminuire la trasmissione del parassita. La rimozione chirurgica di tutti gli oncocercomi accessibili riduce il numero di microfilarie nella cute e può ridurre la prevalenza di cecità dei fiumi, con la contemporanea somministrazione di farmaco. È possibile ridurre le punture delle mosche della specie Simulium evitando le aree infestate, indossando abiti protettivi e usando in maniera abbondante agenti repellenti per insetti. L’uccisione delle larve della mosca nera rappresenta il punto cardine del programma internazionale di controllo dell’oncocerchiasi nell’Africa Occidentale. – Loiasi: Agenti repellenti per insetti possono ridurre l’esposizione alle mosche infette. Comunque, il DEC orale (300 mg una volta a settimana) è l’unica misura di provata efficacia nella prevenzione dell’infezione. Il DEC è l’unico farmaco in grado di uccidere le microfilarie e i vermi adulti. In alcuni casi, lo schema raccomandato di 8-10 mg/kg/die PO per 2-3 sett. deve essere ripetuto. In pazienti con infezioni massive, il trattamento può scatenare un’encefalopatia che può progredire fino allo stato di coma e decesso. Alcuni pazienti possono trarre beneficio da un trattamento iniziale con basse dosi di DEC (1 mg/kg/die) associato alla somministrazione di corticosteroidi. L’Ivermectina alle dosi utilizzate per il trattamento dell’oncocerchiasi può essere una valida ed efficace alternativa al DEC.
Trattamento:
– Filariasi linfatica: la terapia del linfedema cronico può essere molto efficace. La creazione chirurgica di shunt veno-linfatici per migliorare il drenaggio linfatico offre benefici a lungo termine anche in casi avanzati di elefantiasi e le misure conservative come il bendaggio elastico della gamba colpita aiutano a ridurre l’edema. La cura meticolosa della cute, compreso l’uso di pomate antibiotiche e la profilassi con antibiotici sistemici, può far regredire il linfedema e prevenirne la progressione verso l’elefantiasi. – Oncocerchiasi: Il farmaco di scelta è l’Ivermectina somministrata in una singola dose orale di 150 µg/kg una sola volta o due volte in un anno. Essa non deve essere somministrata a bambini di 5 anni di età o di peso 15 kg, alle donne in gravidanza, alle madri che allattano neonati durante la prima sett. di vita e ad ogni persona in gravi condizioni cliniche generali. L’Ivermectina riduce rapidamente il numero di microfilarie nella cute e negli occhi. Essa non sembra essere in grado di uccidere i vermi adulti, ma blocca il rilascio di microfilarie dall’utero per diversi mesi. Gli effetti collaterali sono qualitativamente simili a quelli della dietilcarbamazepina (DEC) ma sono meno frequenti e meno gravi. Il DEC non è più un farmaco raccomandato per il trattamento dell’oncocerchiasi poiché causa nefrotossicità e la reazione di Mazzotti, che può ulteriormente danneggiare la cute e gli occhi e portare a un collasso cardiovascolare, oltre ad accelerare l’insorgenza della cecità nei pazienti con un livello massiccio di infestazione nella camera oculare. La Suramina è efficace ma deve essere somministrata EV per varie settimane. L’eliminazione dei vermi adulti può essere ottenuta anche mediante la rimozione chirurgica dell’oncocercoma. – Loiasi Il DEC è l’unico farmaco in grado di uccidere le microfilarie e i vermi adulti. In alcuni casi, lo schema raccomandato di 8-10 mg/kg/die PO per 2-3 sett. deve essere ripetuto. In pazienti con infezioni massive, il trattamento può scatenare un’encefalopatia che può progredire fino allo stato di coma ed al decesso. Alcuni pazienti possono trarre beneficio da un trattamento iniziale con basse dosi di DEC (1 mg/kg/die) associato alla somministrazione di corticosteroidi. L’Ivermectina alle dosi utilizzate per il trattamento dell’oncocerchiasi può essere una valida ed efficace alternativa al DEC.
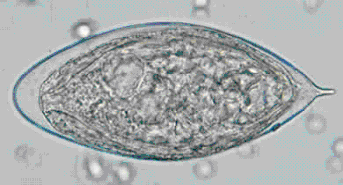
Diagnosi in laboratorio:
la procedura migliore per la determinazione delle microfilarie è l’esame al microscopio (emoscopia). L’esame di campioni di sangue capillare permette la determinazione delle microfilarie da Wuchereria bancrofti, Brugia malayi, Brugia timori, Loa loa, Mansonella perstans, e M. ozzardi. Il campione di sangue può essere uno spesso striscio marcato con Giemsa o ematossilina ed eosina. Per aumentare la sensibilità, i campioni possono essere concentrati mediante centrifugazione del campione di sangue lisato in formalina al 2% (tecnica di Knott), o tramite filtrazione con millipore. Per l’identificazione della microfilaria dell’Onchocerca volvulus e Mansonella streptocerca viene preso un campione di pelle, ottenuta mediante incisione della stessa. Il campione deve essere incubato da 30 min a 2 ore in medium salino o da cultura. In questo caso le micofilarie devono migrare dal tessuto alla fase liquida del campione.

 .
.





 l’uomo viene infettato a causa del morso del Flebotomo, la mosca del deserto (che fa parte della sottofamiglia delle phlebotominae). Queste mosche sono molto piccole, colorate e si nutrono di sangue. Vivono per lo più nella foresta, in grotte o negli anfratti delle rocce. Sia animali selvaggi che l’uomo possono fungere da vettori dell’infezione. La maggior parte delle Leishmaniosi sono originalmente infezioni di piccoli mammiferi (fungono da ‘ospiti serbatoio’) e giocano un ruolo fondamentale nella epidemiologia dell’infezione. Nelle Americhe la leishmaniosi è principalmente trasmessa dalla mosca del genere Lutzomyia, nel resto del mondo invece dal genere Phlebotomus. Le mosche si infettano nutrendosi di sangue da ‘ospiti serbatoio’ o da persone infette.
l’uomo viene infettato a causa del morso del Flebotomo, la mosca del deserto (che fa parte della sottofamiglia delle phlebotominae). Queste mosche sono molto piccole, colorate e si nutrono di sangue. Vivono per lo più nella foresta, in grotte o negli anfratti delle rocce. Sia animali selvaggi che l’uomo possono fungere da vettori dell’infezione. La maggior parte delle Leishmaniosi sono originalmente infezioni di piccoli mammiferi (fungono da ‘ospiti serbatoio’) e giocano un ruolo fondamentale nella epidemiologia dell’infezione. Nelle Americhe la leishmaniosi è principalmente trasmessa dalla mosca del genere Lutzomyia, nel resto del mondo invece dal genere Phlebotomus. Le mosche si infettano nutrendosi di sangue da ‘ospiti serbatoio’ o da persone infette. le 20 specie o più del parassita, provocano diversi tipi di sintomi, alcuni dei quali sono più comuni (febbre, malessere, perdita di peso, anemia); le forme viscerali causano anche l’ingrossamento della milza, del fegato e dei linfonodi.
le 20 specie o più del parassita, provocano diversi tipi di sintomi, alcuni dei quali sono più comuni (febbre, malessere, perdita di peso, anemia); le forme viscerali causano anche l’ingrossamento della milza, del fegato e dei linfonodi.