Rabbia – Scheda malattia
Malattia della Rabbia
- Descrizione
- Agente infettivo
- Porta di ingresso
- Distribuzione
- Trasmissione e Patogenesi
- Incubazione
- Sintomi
- Mortalità
- Controllo e prevenzione
- Trattamento
- Diagnosi
Descrizione:
La rabbia è probabilmente la più antica malattia di cui si ha notizia. La parola “rabbia” deriva dal sanscrito “rabbahs”, che significa “fare violenza”. Risale al trentesimo secolo avanti Cristo, quando in India il dio della Morte era dipinto sempre accompagnato da un cane, emissario, appunto, del trapasso.
La rabbia è una malattia virale a carattere zoonosico. Provoca un’encefalite negli animali, domestici e selvatici. Si trasmette attraverso il contatto diretto con la saliva di animali infetti (morsi, ferite, graffi, soluzioni di continuo della cute o contatto con mucose anche integre). Una volta che i sintomi si sviluppano, la malattia è sempre letale per l’uomo e per gli animali. Nella situazione epidemiologica attuale non determina danni al settore agro-zootecnico nazionale, ponendo esclusivamente gravi rischi di sanità pubblica.
Agente infettivo della Rabbia
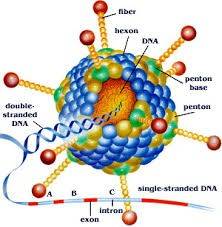
Il virus della rabbia è un virus ad RNA a singola elica che appartiene alla famiglia dei rhabdovirus. All’interno di questa famiglia è compreso il genere Lyssavirus, che include il gruppo degli agenti che causano la rabbia negli animali e negli esseri umani. Virus rabici isolati da diverse specie animali e da diverse zone possiedono differenti proprietà biologiche e antigieniche che possono rendere conto di differenze nella virulenza tra i diversi ceppi isolati. Il virus presenta, inoltre, un particolare tropismo per le fibre muscolari e le cellule nervose, cosa che spiega il particolare decorso della malattia. Esistono diversi genotipi di virus della rabbia con specifici reservoir.
Porta d’Ingresso della Rabbia:
Il morso di animali infetti rappresenta la principale modalità di esposizione alla rabbia; occasionalmente può verificarsi una contaminazione aerea, attraverso aerosol infetti, una contaminazione digestiva o una contaminazione da trapianti di organi infetti. La trasmissione aerea del virus è limitata a situazioni molto particolari, di elevata concentrazione di virus in aerosol, come potrebbe verificarsi in laboratorio o in grotte con popolazioni di pipistrelli infetti.
Rari casi di infezione nell’uomo per via alimentare sono stati segnalati recentemente nel Sud Est Asiatico.
Distribuzione della Rabbia
La rabbia esiste in due forme epidemiologiche: la rabbia urbana, diffusa principalmente dal cane e dal gatto domestici non immunizzati, e la rabbia silvestre, propagata da volpi, tassi, faine, martore, donnole, moffette, manguste, procioni, lupi e pipistrelli. L’infezione negli animali domestici è in genere espressione di una saturazione del serbatoio di infezione selvatico; l’infezione nell’uomo tende, quindi, a verificarsi in zone dove la rabbia è enzootica o epizootica, dove la gran parte degli animali domestici non è immunizzata e dove è comune il contato con l’uomo. Il ciclo urbano è presente prevalentemente in Africa, Asia e Sud America, dove la presenza di animali randagi è molto elevata.
Il ciclo silvestre è predominante in Europa e in Nord America. L’epidemiologia di questo ciclo è piuttosto complessa: vanno tenuti in considerazione il genotipo virale, il comportamento e l’ecologia delle specie ospiti e i fattori ambientali. Nello stesso ecosistema una o più specie possono essere coinvolte nell’epidemiologia della malattia.
Rischio rabbia
La Rabbia nel Mondo
Secondo i dati dell’Organizzazione mondiale di sanità (Oms) la rabbia è ampiamente diffusa in tutto il globo. Ogni anno, a causa di questa malattia, muoiono più di 55 mila persone. Di questi decessi, il 95% si registra in Asia e Africa. Il 99% dei casi di rabbia nell’uomo dipendono da rabbia canina e circa il 30-60% delle vittime di morsi di cane sono bambini minori di 15 anni. Inoltre, oltre 10 milioni di persone ogni anno vengono sottoposte a trattamento post-esposizione a seguito di contatto a rischio con ad animali sospetti rabidi.
Negli ultimi anni, la rabbia dei pipistrelli è emersa come uno dei principali problemi di salute pubblica nelle Americhe e in Europa. Per la prima volta nel 2003 in Sud America sono morte più persone per rabbia da animali selvatici (in particolare pipistrelli) che da cani. Il peso economico della rabbia nei Paesi in via di sviluppo è molto pesante.
Negli Stati Uniti, nel 2008, 49 Stati, il Distretto di Columbia e Porto Rico hanno testato oltre 121 mila animali e riportato ai Cdc più di 6800 casi di rabbia tra gli animali e 2 casi nell’uomo. Il totale dei casi riferiti è sceso di circa il 3,1% rispetto al 2007. Il 93% dei casi registrati nel 2008 riguarda animali selvatici e il 7% animali domestici. Il numero dei decessi tra gli uomini è di circa 2-3 all’anno.
La Rabbia in Europa
In Europa, nonostante zone molto estese abbiano ottenuto lo status di libere da rabbia, la vaccinazione degli animali da compagnia rimane una fase importante della prevenzione.
La rabbia in Europa è prevalentemente rabbia silvestre: alle specie selvatiche è attribuito l’80% di tutti i casi di rabbia. Di questi, più dell’80% è legato a volpi rosse (Vulpes vulpes), appartenenti alla famiglia dei Canidae. La vaccinazione orale delle volpi, sviluppata ormai quasi 25 anni fa, ha offerto una nuova prospettiva per il controllo della rabbia tra le specie selvatiche. Questo metodo, è stato provato come l’unico modo efficace per eliminare la rabbia tra le volpi e tra altre specie terrestri: se si elimina la rabbia tra le volpi scompare anche tra gli altri animali domestici.
I risultati ottenuti con questo metodo sono significativi, il numero annuale di casi di rabbia è sceso da 21 mila nel 1990 a 5400 nel 2004. Nella maggior parte delle zone dell’Europa occidentale e centrale la rabbia è stata eradicata e il controllo è stato di successo. A oggi, molti Paesi sono considerati liberi da rabbia. In Francia nel 2004 e nel 2008 si sono verificati due casi di rabbia, diagnosticati entrambi in cani importati dal Marocco. Nel 2004 in Germania sono stati segnalati tre casi di rabbia post-trapianto su sei pazienti che avevano ricevuto organi dalla stessa donatrice.
La Rabbia in Italia
Dal 1997 e fino all’ottobre 2008, l’Italia è stata considerata libera da rabbia (rabies free). Successivamente, secondo i dati dell’Istituto zooprofilattico sperimentale delle Venezie (IZSVe), dal 2008 a febbraio 2010, sono stati diagnosticati centinaia di casi di rabbia in animali in Friuli-Venezia Giulia, in Veneto e nella Provincia Autonoma di Trento. I casi di rabbia diagnosticati sono da mettere in stretta correlazione con la situazione epidemiologica della rabbia silvestre nella vicina Slovenia.
Nel corso del 2009 e inizio 2010 l’epidemia si è diffusa in direzione Sud-Ovest, comprendendo il Friuli Venezia Giulia, il Veneto in particolare la provincia di Belluno, fino ai casi più recenti riscontrati nella provincia di autonoma di Trento.
La prevalenza dei casi ha interessato gli animali selvatici, per lo più le volpi, che rappresentano il principale serbatoio della malattia, ed alcuni caprioli e tassi. Sono stati riscontrati positivi anche animali domestici tra cui cani, gatti, un cavallo ed un asino.
Le autorità veterinarie nazionali e locali hanno messo in atto tutte le misure sanitarie necessarie al controllo della diffusione della malattia. Grazie a questi interventi, la malattia è ritenuta sotto controllo e al momento si assiste ad una riduzione dei casi accertati: infatti si è passati dalle 49 positività al virus registrate nelle volpi nel mese di gennaio 2010, ai 9 casi dell’ultimo mese (Giugno 2010).

Trasmissione e Patogenesi:
La trasmissione del virus della rabbia agli esseri umani di solito è dovuta al morso di un animale infetto, ma può avvenire anche tramite contatto diretto delle membrane mucose o di ferite dell’epidermide con materiale infetto (ad es. saliva, tessuti neurali, fluido cerebrospinale). La replicazione virale comincia all’interno delle fibrocellule muscolari striate prossime al punto di inoculazione. Il virus si diffonde poi in direzione centripeta lungo il nervo sino al sistema nervoso centrale in cui si moltiplica; quindi prosegue attraverso i nervi efferenti verso le ghiandole salivari e compare nella saliva. L’autopsia (post-mortem) mostra un intasamento vasale con emorragie puntiformi nelle meningi e nel cervello; l’esame microscopico mostra raccolte perivascolari di linfociti con distruzione minima delle cellule nervose. Corpi inclusi intracitoplasmatici (corpi di Negri), solitamente nel corno di Ammone, sono patognomonici della rabbia, anche se non sono sempre presenti.
Incubazione:
Il periodo di incubazione della rabbia è assai variabile, oscillando da 7 giorni a più di un anno (in media 1-2 mesi). La latenza sembra dipendere dalla carica infettante, dall’estensione dell’interessamento tissutale in sede di inoculo, dai meccanismi di difesa dell’ospite e dalla distanza che il virus deve coprire dalla sede di inoculazione al sistema nervoso centrale. I tassi di infezione e la mortalità sono elevati a seguito di morsi sul capo o sul tronco, minori in occasione di morsi sugli arti inferiori.
Sintomi della Rabbia :
Le manifestazioni cliniche della rabbia (forma furiosa, 75% dei casi) configurano 4 stadi:
1.una sindrome prodromica aspecifica: dura circa da 1 a 4 giorni ed è caratterizzata da febbre, cefalea, malessere, mialgie, astenia ingravescente, anoressia, nausea e vomito, mal di gola e tosse non produttiva; un sintomo fortemente suggestivo, presente nel 50-80% dei pazienti, è rappresentato dalla comparsa di parestesie e/o fascicolazioni nella sede dell’inoculo;
2. una fase encefalitica acuta, generalmente preceduta da periodi di iperattività motoria, ipereccitabilità e agitazione; rapidamente compaiono confusione, allucinazioni, aggressività, bizzarre aberrazioni del pensiero, spasmi muscolari, meningismo, convulsioni e paralisi distrettuali; i periodi di alterazione mentale si alternano a periodi di perfetta lucidità, ma con il procedere della malattia questi ultimi si fanno più rari finchè il paziente cade in coma; molto comune è l’iperestesia con eccessiva sensibilità alla luce intensa, ai rumori forti, al tocco e talvolta anche allo sfioramento. La temperatura corporea può raggiungere i 40°C; comune è la paralisi delle corde vocali;
3. una fase encefalitica di tipo rabico da profonda alterazione dei centri del tronco encefalico: l’interessamento dei nervi cranici causa diplopia, paralisi facciali, neurite ottica e la caratteristica difficoltà alla deglutizione; questa, associata all’eccessiva salivazione, dà luogo al tipico quadro di “bava alla bocca”; nel 50% dei casi compare idrofobia, ovvero una dolorosa, violenta contrazione involontaria del diaframma e dei muscoli respiratori accessori, faringei e laringei, scatenata dall’ingestione di liquidi; il paziente diventa comatoso e l’interessamento dei centri respiratori determina una morte per apnea.
4. morte, o in rari casi, guarigione: in assenza di una terapia rianimatoria, la sopravvivenza media dall’esordio dei sintomi è di quattro giorni. La guarigione è eccezionale e quando si verifica è graduale.
La forma paralitica (25% dei casi) è caratterizzata da una paralisi ascendente del tipo sindrome di Landry/Guillain-Barrè (rabbia muta, rabbia tranquilla); si osserva più frequentemente in coloro che sono stati morsicati da pipistrelli o in coloro che hanno ricevuto una profilassi post-esposizione; si manifesta, inoltre, nel sud-est asiatico in soggetti morsicati da cani.
Controllo e prevenzione della rabbia:
In generale, la letteratura scientifica disponibile è concorde nell’affermare che il controllo della rabbia si identifica nella rigorosa attuazione degli interventi codificati da norme di polizia veterinaria, specificamente mirati alla protezione dell’uomo nei confronti della malattia.
La prevenzione nei confronti della rabbia si basa sulla vaccinazione preventiva degli animali domestici, sulla lotta al randagismo e su altri provvedimenti finalizzati a impedire contatti a rischio con le popolazioni selvatiche.
Per quanto riguarda la prevenzione della rabbia negli animali è importante :
la vaccinazione antirabbica (obbligatoria o volontaria a seconda del dato epidemiologico) degli animali domestici, la lotta al randagismo e l’attuazione di provvedimenti coercitivi (cattura ed eventuale abbattimento) al fine di realizzare, attorno all’uomo, un anello di protezione costituito da animali domestici non recettivi e, quindi, incapaci di trasmettere l’infezione (prevenzione del ciclo urbano della malattia);
la vaccinazione orale dei carnivori selvatici, volpi in particolare, introdotta da più di un decennio in alcuni paesi europei.
A seguito di tale misura è stato osservato un significativo decremento dell’incidenza della malattia, rilevato attraverso piani di sorveglianza sul serbatoio selvatico (prevenzione e controllo del ciclo silvestre della malattia).
Prevenzione della Rabbia:
Nell’uomo, la prevenzione della malattia si basa sulla vaccinazione preventiva per chi svolge attività professionale “a rischio specifico” (veterinari, guardie forestali, cinovigili, guardie venatorie ecc.), sulla vaccinazione pre-contagio e sul trattamento vaccinale post-esposizione che sarà considerato di volta in volta in funzione della tipologia di esposizione verificatasi.
Le linee guida Oms individuano tre tipologie di esposizione:
– contatto di una superficie cutanea intatta con animali, con le loro mucose o con il loro cibo (se la ricostruzione dei fatti è attendibile, non c’è esposizione e quindi non è necessaria una profilassi);
– graffi minori o abrasioni senza sangue o leccate di animali su pelle tagliata e piccoli morsi su pelle abrasa (si consiglia sola la vaccinazione), morsi singoli o multipli transdermici, graffi o contaminazione della membrana della mucosa con saliva o contatti sospetti con pipistrelli (in questo caso si devono somministrare sia le immunoglobuline, che il vaccino).
Le cure post-esposizione per prevenire la rabbia includono la pulizia e la disinfezione della ferita o dei punti di contatto e la somministrazione precoce della vaccinazione (se necessaria), senza aspettare i risultati dei test diagnostici di laboratorio e, comunque, senza ritardi per l’osservazione dell’animale sospetto. Per quanto riguarda le immunoglobuline, non ci sono limiti di tempo alla somministrazione. La maggior parte delle immunoglobuline deve essere somministrata in profondità nella ferita, mentre la parte restante, se avanza, dovrebbe essere iniettata in un altro sito muscolare aggiuntivo lontano dalla ferita. L’Oms raccomanda, infine, l’osservazione dell’animale sospetto per 10 giorni, perché i primi sintomi nei cani e nei gatti non sono molto specifici. Francia, Spagna e Inghilterra raccomandano 14 giorni di osservazione.
Trattamento della Rabbia:
All’insorgenza dei sintomi neurologici la rabbia non è curabile.
Diagnosi:
La diagnosi clinica della rabbia non è affidabile. La diagnosi definitiva può essere fatta solo con l’esame di laboratorio. La diagnosi post-mortem è effettuata sul SNC e comprende come test di elezione l’immunofluorescenza diretta (FAT) e l’isolamento del virus in coltura cellulare (RTCIT). La RT-PCR e le altre tecniche di amplificazione sono di solito utilizzate come test di conferma.
La diagnosi intra-vitam è utilizzata spesso nell’uomo a partire da saliva, urina, liquido cefalorachidiano e biopsia cutanea effettuata sulla nuca e prevede tecniche di FAT, RTCIT e RT-PCR. L’ulteriore caratterizzazione dell’isolato virale avviene mediante sequenziamento o l’utilizzo di anticorpi monoclonali.
Rabbia – Scheda malattia Leggi tutto »









 la mosca TseTse, sia maschio che femmina, fa da vettore fra uomo e uomo, gli animali selvatici e i bovini invece fungono da serbatoi per l’infezione. Una volta nel corpo umano, il tripanosoma si moltiplica e invade la maggior parte dei tessuti.
la mosca TseTse, sia maschio che femmina, fa da vettore fra uomo e uomo, gli animali selvatici e i bovini invece fungono da serbatoi per l’infezione. Una volta nel corpo umano, il tripanosoma si moltiplica e invade la maggior parte dei tessuti.
 .
.


 l’uomo viene infettato a causa del morso del Flebotomo, la mosca del deserto (che fa parte della sottofamiglia delle phlebotominae). Queste mosche sono molto piccole, colorate e si nutrono di sangue. Vivono per lo più nella foresta, in grotte o negli anfratti delle rocce. Sia animali selvaggi che l’uomo possono fungere da vettori dell’infezione. La maggior parte delle Leishmaniosi sono originalmente infezioni di piccoli mammiferi (fungono da ‘ospiti serbatoio’) e giocano un ruolo fondamentale nella epidemiologia dell’infezione. Nelle Americhe la leishmaniosi è principalmente trasmessa dalla mosca del genere Lutzomyia, nel resto del mondo invece dal genere Phlebotomus. Le mosche si infettano nutrendosi di sangue da ‘ospiti serbatoio’ o da persone infette.
l’uomo viene infettato a causa del morso del Flebotomo, la mosca del deserto (che fa parte della sottofamiglia delle phlebotominae). Queste mosche sono molto piccole, colorate e si nutrono di sangue. Vivono per lo più nella foresta, in grotte o negli anfratti delle rocce. Sia animali selvaggi che l’uomo possono fungere da vettori dell’infezione. La maggior parte delle Leishmaniosi sono originalmente infezioni di piccoli mammiferi (fungono da ‘ospiti serbatoio’) e giocano un ruolo fondamentale nella epidemiologia dell’infezione. Nelle Americhe la leishmaniosi è principalmente trasmessa dalla mosca del genere Lutzomyia, nel resto del mondo invece dal genere Phlebotomus. Le mosche si infettano nutrendosi di sangue da ‘ospiti serbatoio’ o da persone infette. le 20 specie o più del parassita, provocano diversi tipi di sintomi, alcuni dei quali sono più comuni (febbre, malessere, perdita di peso, anemia); le forme viscerali causano anche l’ingrossamento della milza, del fegato e dei linfonodi.
le 20 specie o più del parassita, provocano diversi tipi di sintomi, alcuni dei quali sono più comuni (febbre, malessere, perdita di peso, anemia); le forme viscerali causano anche l’ingrossamento della milza, del fegato e dei linfonodi.